Fosfortrichloride
Fosfortrichloride (PCl3) is een zeer toxische en corrosieve vloeistof met een scherpe geur, die hevig reageert in contact met water tot fosforigzuur en waterstofchloride:
Fosfortrichloride
| |||||
| Structuurformule en molecuulmodel | |||||
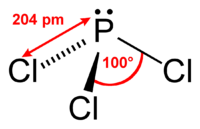 | |||||
Structuurformule van fosfortrichloride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | PCl3 | ||||
| IUPAC-naam | fosfortrichloride | ||||
| Molmassa | 137,33 g/mol | ||||
| CAS-nummer | 7719-12-2 | ||||
| EG-nummer | 231-749-3 | ||||
| Beschrijving | Kleurloze vloeistof met karakteristieke scherpe geur[1] | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H300 - H314 - H330 - H373 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P260 - P264 - P280 - P284 - P301+P310 - P305+P351+P338 | ||||
| EG-Index-nummer | 015-007-00-4 | ||||
| VN-nummer | 1809 | ||||
| ADR-klasse | Gevarenklasse 6.1 | ||||
| MAC-waarde | 0,5 ppm 2,8 mg/m³[1] | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar[1] | ||||
| Kleur | kleurloos[1] | ||||
| Dichtheid | 1,574[1] g/cm³ | ||||
| Smeltpunt | −112[1] °C | ||||
| Kookpunt | 76,1[1] °C | ||||
| Dampdruk | (bij 20°C) 12.700[1] Pa | ||||
| Goed oplosbaar in | di-ethylether, tolueen | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Het is een belangrijke stof in de chemische industrie, vooral als tussenproduct voor de productie van andere verbindingen.
Synthese
Fosfortrichloride wordt op industriële schaal bereid door witte fosfor te laten reageren met een beperkte hoeveelheid watervrij chloorgas (overmaat chloor leidt tot de vorming van fosforpentachloride):
Fosfortrichloride kan ook bereid worden door dampen van fosforylchloride (POCl3) te reduceren met koolstof bij verhoogde temperatuur:
Deze reactie is een carbothermische reductie.
Structuur en eigenschappen
Fosfortrichloride bezit een vrij elektronenpaar op fosfor, waardoor een trigonaal piramidale structuur ontstaat. Dit wordt voorspeld door de VSEPR-theorie. Net zoals fosfortrifluoride en fosfortribromide kan ook deze verbinding optreden als lewiszuur en lewisbase.
Toepassingen
Fosfortrichloride wordt vooral gebruikt als tussenproduct (intermediair) in de synthese van andere verbindingen, waaronder pesticiden, biociden, vlamvertragers en geneesmiddelen.
Toxicologie en veiligheid
Naast de hevige reactie met water, reageert fosfortrichloride ook met alcoholen, fenolen en basen.
Het is een zeer corrosieve stof, die metalen en vele andere materialen aantast.
Fosfortrichloride is zeer toxisch. Inademing van de dampen kan longoedeem veroorzaken. De stof is corrosief en tast ogen, huid en luchtwegen uit. Een gevaarlijke concentratie van fosfortrichloride in de lucht kan door verdamping bij 20 °C zeer snel worden bereikt. De dampen zijn zwaarder dan lucht.
De grenswaarde voor blootstelling aan fosfortrichloride is 0,2 ppm (1,1 mg/m³) als tijdgewogen gemiddelde over 8 uur. Voor kortetijdblootstelling (max. 15 minuten) geldt een maximale toegelaten concentratie (MAC-waarde) van 0,5 ppm (2,8 mg/m³).
Externe link
Bronnen, noten en/of referenties
|


