Fosforpentachloride
Fosforpentachloride (PCl5) is een zeer toxische en corrosieve anorganische verbinding. Het is een van de belangrijkste fosforchlorides, samen met fosfortrichloride en fosforylchloride. Het is goed oplosbaar in koolstofdisulfide, halogeenalkanen (zoals dichloormethaan en tetrachloormethaan) en benzeen. In water ontleedt het heftig onder vorming van fosforzuur en waterstofchloride:
Fosforpentachloride
| |||||
| Structuurformule en molecuulmodel | |||||
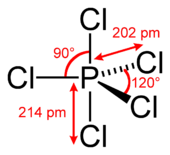 | |||||
Structuurformule van fosforpentachloride | |||||
 | |||||
Fosforpentachloride in een ampul | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | PCl5 | ||||
| IUPAC-naam | fosforpentachloride | ||||
| Molmassa | 208,22 g/mol | ||||
| CAS-nummer | 10026-13-8 | ||||
| Beschrijving | Kleurloze kristallen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H314 - H330 - H373 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P260 - P280 - P284 - P305+P351+P338 - P310 | ||||
| VN-nummer | 1806 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 1,6 g/cm³ | ||||
| Kookpunt | 159-160 (Sublimeert) °C | ||||
| Sublimatiepunt | 70-80 °C | ||||
| Goed oplosbaar in | water, koolstofdisulfide, halogeenalkanen, benzeen | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 0 D | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Fosforpentachloride werd voor het eerst beschreven door Humphry Davy in 1810.[1]
Synthese
Fosforpentachloride kan bereid worden door fosfortrichloride te laten reageren met chloorgas:[2]
Dit is een evenwichtsreactie. Bij verhoogde temperatuur treedt, conform het principe van Le Chatelier, een evenwichtsverschuiving naar de reagentia op.
Toepassingen
Omdat fosforpentachloride makkelijk chloorgas vrijstelt, wordt het gebruikt in veel chloreringsreacties, zowel van organische als van anorganische verbindingen. Het wordt vooral geschikt om hydroxylgroepen te vervangen door chloor: organische zuren of zuuranhydriden kunnen ermee omgezet worden in zuurchloriden[3] en alcoholen in alkylchloriden (bijvoorbeeld methanol in methylchloride).
Met zwaveldioxide vormt het thionylchloride en fosforylchloride:
Ook met oxaalzuur, boorzuur of fosforpentoxide vormt het fosforylchloride:
In het labo wordt meestal thionylchloride in plaats van fosforpentachloride gebruikt als chloreringsmiddel, omdat daarbij zwaveldioxide (een gas) vrijkomt, dat gemakkelijker uit het reactiemengsel kan verwijderd worden dan fosforylchloride (een vloeistof).
Fosforpentachloride is ook een dehydrogeneringsreagens. Het is ook een katalysator of co-katalysator van sommige chemische reacties, waaronder de Beckmann-omlegging.
Externe links
| Bronnen, noten en/of referenties |


