Zwavelchloride
Zwavelchloride (S2Cl2) is een anorganische verbinding van zwavel en chloor. De stof komt voor als een gele, amberkleurige tot geelachtig-rode, viskeuze en rokende vloeistof met een scherpe geur, die hevig reageert met water. Ze is oplosbaar in verschillende organische oplosmiddelen: ethanol, benzeen, di-ethylether, chloroform en tetrachloormethaan.
Zwavelchloride
| |||||
| Structuurformule en molecuulmodel | |||||
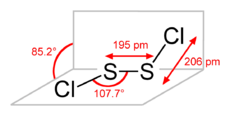 | |||||
Structuurformule van zwavelchloride | |||||
 | |||||
Molecuulmodel van zwavelchloride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | S2Cl2 | ||||
| IUPAC-naam | dizwaveldichloride | ||||
| Andere namen | zwavelmonochloride, dichloordisulfaan | ||||
| Molmassa | 135,036 g/mol | ||||
| SMILES | ClSSCl | ||||
| CAS-nummer | 10025-67-9 | ||||
| EG-nummer | 233-036-2 | ||||
| PubChem | 24807 | ||||
| Beschrijving | Gele tot geelachtig-rode viskeuze vloeistof met scherpe geur | ||||
| Vergelijkbaar met | zwaveldichloride | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H314 - H332 - H400 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P273 - P280 - P301+P310 - P305+P351+P338 - P310 | ||||
| Opslag | Gescheiden van sterk oxiderende stoffen, peroxiden, fosforoxiden, organische producten, voeding en voedingsmiddelen. Koel, droog en goed gesloten bewaren. Verluchting langs de vloer. | ||||
| EG-Index-nummer | 016-012-00-4 | ||||
| VN-nummer | 1828 | ||||
| ADR-klasse | Gevarenklasse 8 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | geel | ||||
| Dichtheid | 1,688 g/cm³ | ||||
| Smeltpunt | −80 °C | ||||
| Kookpunt | 138 °C | ||||
| Vlampunt | (gesloten vat) 118,5 °C | ||||
| Zelfontbrandings- temperatuur | 234 °C | ||||
| Dampdruk | (bij 20°C) 900 Pa | ||||
| Goed oplosbaar in | ethanol, benzeen, di-ethylether, chloroform, tetrachloormethaan | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 1,60 D | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Structuur
De moleculaire geometrie van de verbinding is analoog aan die van waterstofperoxide. De twee vlakken (respectievelijk Cla-S-S en S-S-Clb) staan bijna loodrecht op elkaar: de torsiehoek bedraagt 85,2°. Er bestaat ook een structuurisomeer van zwavelchloride: S=SCl2. Deze wordt gevormd wanneer zwavelchloride wordt blootgesteld aan UV-licht.
Reacties
Zwavelchloride reageert hevig met water, waardoor zwaveldioxide, waterstofchloride en zwavel gevormd worden:
Wanneer een reactie van zwavelchloride met chloorgas wordt uitgevoerd, ontstaat er zwaveldichloride:
Toepassingen
Zwavelchloride wordt vooral gebruikt om C-S-bindingen aan te maken. Met aluminiumchloride (AlCl3) als katalysator reageert zwavelchloride met benzeen tot difenylsulfide:
De Herz-reactie is de omzetting van een aniline-derivaat (1) naar een zogenaamd Herz-zout (2) met zwavelchloride, gevolgd door hydrolyse van dit Herz-zout naar het overeenkomstige natriumthiolaat (3):
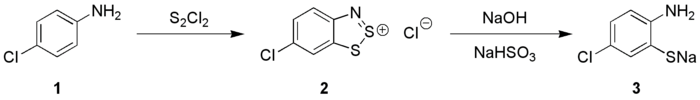 Herz-reactie
Herz-reactie
Toxicologie en veiligheid
De stof ontleedt bij verhitting of bij verbranding, met vorming van giftige en corrosieve dampen, onder andere waterstofchloride, waterstofsulfide en zwaveloxiden. Ze reageert met peroxiden, fosforoxiden en sommige organische verbindingen, waardoor brand- en ontploffingsgevaar ontstaat. Zwavelchloride reageert hevig met water, waarbij zwavel, waterstofchloride, zwaveldioxide, waterstofsulfide, sulfiet en thiosulfaat gevormd worden. Ze tast ook vele metalen aan in aanwezigheid van water of vocht.
De stof is corrosief voor de ogen, de huid en de luchtwegen. Inademing van de damp kan longoedeem veroorzaken.


