Uraniumhexafluoride
Uraniumhexafluoride of uranium(VI)fluoride (ook wel afgekort tot hex) is een anorganische verbinding van fluor en uranium, met als brutoformule UF6. Het belang van de verbinding ligt erin, dat het de enige praktische methode is om het zware uranium in een gasvormige verbinding te brengen voor de verrijking van uranium door ultracentrifuge of gasdiffusie. Bij kamertemperatuur is het een kleurloze tot witte kristallijne vaste stof, die zeer hevig reageert met water.
Uraniumhexafluoride
| |||||
| Structuurformule en molecuulmodel | |||||
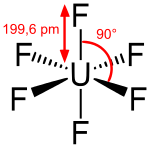 | |||||
Structuurformule van uranium(VI)fluoride | |||||
 | |||||
Kristallen van uraniumhexafluoride in een ampul | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | UF6 | ||||
| IUPAC-naam | uraniumhexafluoride uranium(VI)fluoride | ||||
| Andere namen | uraniumhexafluoride | ||||
| Molmassa | 352,019329 g/mol | ||||
| SMILES | F[U](F)(F)(F)(F)F | ||||
| InChI | 1S/6FH.U/h6*1H;/q;;;;;;+6/p-6 | ||||
| CAS-nummer | 7783-81-5 | ||||
| EG-nummer | 232-028-6 | ||||
| PubChem | 24560 | ||||
| Beschrijving | Radioactieve kleurloze tot witte vaste stof | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H330 - H300 - H373 - H411 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | geen | ||||
| Carcinogeen | ja | ||||
| VN-nummer | 2977 | ||||
| MAC-waarde | 1 mg/m³ | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | kleurloos-wit | ||||
| Dichtheid | (bij 20,7°C) 5,09 g/cm³ | ||||
| Sublimatiepunt | 56,54 °C | ||||
| Dampdruk | 15.300 Pa | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 0 D | ||||
| Thermodynamische eigenschappen | |||||
| ΔfH | −2197,7 kJ/mol | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
De standaardmethode ter bereiding van uraniumhexafluoride is de reactie van uranium(IV)fluoride (uraniumdioxide) met fluorgas:
De reactie is endotherm en wordt doorgaans uitgevoerd bij temperaturen boven 250 °C. Als alternatief voor fluorgas kan xenondifluoride worden gebruikt:
Uraniumhexafluoride kan daarnaast ook bereid worden uit reactie van uranium(V)chloride met fluorgas:
Een gelijkaardige reactie is deze van uranium(V)chloride met waterstoffluoride:
Deze laatste reactie is echter weinig geschikt, omdat het ontstane uraniumhexafluoride zeer slecht kan gescheiden worden van waterstoffluoride.
Uraniumhexafluoride laat zich ook bereiden uit uranium(IV)oxide door reactie met een halogeenfluoride, zoals chloortrifluoride, broomtrifluoride of broompentafluoride. De reactiviteit van dergelijke verbindingen ligt hoger dan die van fluorgas. Zo treedt de omzetting met broomtrifluoride reeds bij 50 °C op, terwijl de overeenkomstige reactie met fluorgas pas bij 400 °C doorgaat. Als alternatief voor uranium(IV)oxide kan ook elementair uranium gebruikt worden, maar deze reactie is bijzonder heftig en kan leiden tot explosies.
Eigenschappen en toepassingen
Uraniumhexafluoride sublimeert bij 56,54 °C. Dit punt kan worden verlaagd door de druk te verlagen. Uraniumhexafluoride kan onder verlaagde druk al bij kamertemperatuur deels gasvormig worden. Uraniumhexafluoride in een goed afgesloten vat op kamertemperatuur is de gangbare methode om gebruikt uranium te vervoeren van een kerncentrale naar een verrijkingsfabriek als URENCO. In gasvormige toestand wordt het door ultracentrifuges geleid, tot verrijkt uranium is ontstaan. Dit verrijkte uranium wordt ook weer, in grotendeels vaste vorm, teruggestuurd naar de klant.
Toxicologie en veiligheid
Uraniumhexafluoride is ongeveer even giftig als cadmium of kwik, maar de stof is sterk corrosief en bijzonder reactief. Als gasvormig uraniumhexafluoride in contact komt met water (of vochtige lucht) ontstaat het corrosieve waterstoffluoride. Uraniumhexafluoride is daarnaast ook radioactief.
Externe links
- (en) Gegevens van Uranium(VI)fluoride in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)


