Tetramethylethyleendiamine
Tetramethylethyleendiamine (vaak afgekort tot TMEDA of soms tot TEMED) is een organische verbinding met als brutoformule C6H16N2. De stof komt voor als een ontvlambare kleurloze vloeistof, die goed oplosbaar is in water. De vloeistof heeft een kenmerkende geur, die door veel mensen als visachtig omschreven wordt.[1]
Tetramethylethyleendiamine
| |||||
| Structuurformule en molecuulmodel | |||||
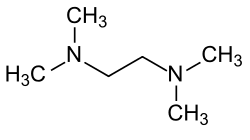 | |||||
Structuurformule van TMEDA | |||||
 | |||||
Molecuulmodel van TMEDA | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C6H16N2 | ||||
| IUPAC-naam | N,N,N',N'-tetramethyl- ethaan-1,2-diamine | ||||
| Andere namen | TEMED TMEDA TMED 1,2-bis(dimethylamino)ethaan | ||||
| Molmassa | 116,20464 g/mol | ||||
| SMILES | NC(C)(C)C(N)(C)C | ||||
| InChI | 1S/C6H16N2/c1-5(2,7)6(3,4)8/h7-8H2,1-4H3 | ||||
| CAS-nummer | 110-18-9 | ||||
| EG-nummer | 203-744-6 | ||||
| PubChem | 123390 | ||||
| Beschrijving | Kleurloze vloeistof | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H225 - H302 - H314 - H332 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P210 - P280 - P305+P351+P338 - P310 | ||||
| VN-nummer | 2372 | ||||
| ADR-klasse | Gevarenklasse 3 | ||||
| LD50 (ratten) | (oraal) 268 mg/kg | ||||
| LD50 (konijnen) | (huid) 5390 mg/kg | ||||
| LD50 (muizen) | (oraal) 630 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,78 g/cm³ | ||||
| Smeltpunt | −55 °C | ||||
| Kookpunt | 120-122 °C | ||||
| Vlampunt | 50 °C | ||||
| Goed oplosbaar in | water | ||||
| Brekingsindex | 1,4179 (589 nm, 20 °C) | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 0 D | ||||
| Evenwichtsconstante(n) | pKa = 8,97 | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Toepassingen
Complexering
TMEDA wordt veel gebruikt als ligand voor (transitie)metaalionen. Veel metaalhaliden, zoals zinkchloride en koper(I)jodide, vormen stabiele complexen met TMEDA die oplosbaar zijn in organische oplosmiddelen. In dergelijke complexen gedraagt TMEDA zich als een bidentaat ligand.
TMEDA vormt met lithiumionen zeer stabiele complexen.[1] Zo wordt n-butyllithium (n-BuLi) omgezet in een cluster met een hogere reactiviteit dan die van het hexameer. n-BuLi-TMEDA is in staat één of soms zelfs twee waterstofatomen te onttrekken aan een groot aantal verbindingen (en te vervangen door lithium). Dit proces wordt metallatie genoemd. Onder dergelijk verbindingen zijn benzeen, furaan, thiofeen, N-alkyl-pyrrolen en ferroceen.[1] Veel negatief geladen organometaalverbindingen zijn geïsoleerd als hun [Li(tmeda)2]+-complexen.[2] In deze complexen gedraagt het kation [Li(tmeda)2]+ zich als een quaternair ammoniumzout, vergelijkbaar met [NEt4]+.
Andere toepassingen
TMEDA wordt, in combinatie met ammoniumpersulfaat, gebruikt als katalysator in de polymerisatie van acrylamide tot polyacrylamidegels, die gebruikt worden in de gelelektroforese. Hoewel de gebruikte hoeveelheden verschillen per toepassing is een gehalte van 0,1-0,2% v/v TMEDA gebruikelijk.
Toxicologie en veiligheid
TMEDA is corrosief en zeer schadelijk voor de gezondheid. Het kan schade berokkenen aan ogen, luchtwegen, slijmvliezen en de huid, met irritatie en brandwonden tot gevolg. De vloeistof kan via de huid worden opgenomen. TMEDA is niet carcinogeen.
Chemisch gezien is het zeer reactief: het moet strikt gescheiden worden van sterke oxidatoren, sterke en zwakke zuren, zuurchloriden, zuuranhydriden, koper en kwik. Het kan evenwel stabiel worden opgeslagen, mits aan voorgaande voorwaarden is voldaan.
Zie ook
Externe link
- (en) Gegevens van Tetramethylethyleendiamine in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van tetramethylethyleendiamine
Bronnen, noten en/of referenties
|


