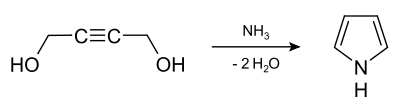Pyrrool
Pyrrool is een heterocyclische aromatische verbinding met als brutoformule C4H5N. De zuivere stof komt voor als een kleurloze vloeistof met een chloroformachtige geur, die slecht oplosbaar is in water. Structureel gezien bestaat het uit een vijfring die opgebouwd is uit vier koolstofatomen en één stikstofatoom.
Pyrrool
| |||||
| Structuurformule en molecuulmodel | |||||
 | |||||
Structuurformule van pyrrool | |||||
 | |||||
Molecuulmodel van pyrrool | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C4H5N | ||||
| IUPAC-naam | 1H-pyrrool | ||||
| Andere namen | azool, divinyleenimine, imidool | ||||
| Molmassa | 67,0892 g/mol | ||||
| SMILES | C1=CNC=C1 | ||||
| InChI | 1S/C4H5N/c1-2-4-5-3-1/h1-5H | ||||
| CAS-nummer | 109-97-7 | ||||
| EG-nummer | 203-724-7 | ||||
| PubChem | 8027 | ||||
| Beschrijving | Kleurloze vloeistof met chloroform-achtige geur | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H226 - H301 - H315 - H318 - H331 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P261 - P280 - P301+P310 - P305+P351+P338 - P311 | ||||
| VN-nummer | 1993 | ||||
| ADR-klasse | Gevarenklasse 3 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,97[1] g/cm³ | ||||
| Smeltpunt | −24[1] °C | ||||
| Kookpunt | 131[1] °C | ||||
| Vlampunt | 39[1] °C | ||||
| Zelfontbrandings- temperatuur | 550[1] °C | ||||
| Dampdruk | 87 Pa | ||||
| Oplosbaarheid in water | 60[1] g/l | ||||
| Goed oplosbaar in | ethanol, di-ethylether, ethylacetaat, pyridine, benzeen, tolueen | ||||
| Slecht oplosbaar in | water | ||||
| Brekingsindex | 1,5082 (589 nm, 20 °C) | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
In verschillende organismen is pyrrool een belangrijke stof. Het heem in hemoglobine bestaat uit vier pyrroolringen die met elkaar verbonden zijn. Verder komt de structuur voor in chlorofyl in planten en in bacteriën. Het vormt een onderdeel van vitamine B12 en de basis voor indigokleurstoffen.
Synthese
Op industriële schaal wordt pyrrool bereid door de reactie met furaan met ammoniak:
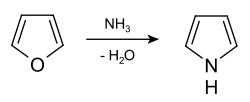 Synthese van pyrrool
Synthese van pyrrool
Een alternatieve synthesemethode is het verhitten van 1,4-butyndiol met ammoniak onder hoge druk:
Gesubstitueerde pyrroolderivaten kunnen bereid worden via specifieke organische reacties, zoals de Knorr-pyrroolsynthese, de Paal-Knorr-synthese en de Hantzsch-pyrroolsynthese.
Structuur en eigenschappen
Reactiviteit
In tegenstelling tot pyridine neemt het vrij elektronenpaar op stikstof wel deel van het aromatisch systeem in de ring. Dit heeft tot gevolg dat de elektronendensiteit in de ring hoger wordt en dat de elektrofiele aromatische substitutie vlotter verloopt. Bij pyrrool treedt bij voorkeur substitutie op de α-plaats (het koolstofatoom naast het heteroatoom) op, omdat de positieve lading door resonantie wordt gestabiliseerd (onder andere op het heteroatoom, waardoor alle elementen hun octetconfiguratie bezitten). De Bischler-Napieralski-reactie is een voorbeeld waarbij elektrofiele aromatische substitutie plaatsgrijpt bij pyrrool:[2]
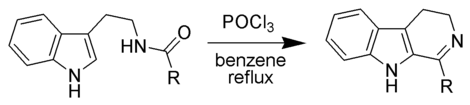 Algemeen reactieverloop van de Bischler-Napieralski-reactie
Algemeen reactieverloop van de Bischler-Napieralski-reactie
Zuur-base-eigenschappen
De pKa van het op stikstof geprotoneerde pyrroliumion bedraagt −0,3. Deze negatieve waarde betekent dat pyrrool zelfs in 1 mol/L zwavelzuur voor de helft als niet-geprotoneerd pyrrool voorkomt. De pKa van pyrrool zelf bedraagt 25 en derhalve is dus een zeer sterke base nodig om pyrrool te deprotoneren. De reactie met metallisch kalium levert kaliumpyrrolide:
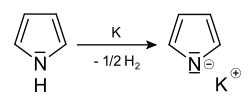 Deprotonering van pyrrool
Deprotonering van pyrrool
Zie ook
Externe links
- (en) MSDS van pyrrool
Bronnen, noten en/of referenties
|