Silaan
Silaan is een siliciumverbinding met als brutoformule SiH4. Het is een kleurloos gas met een onaangename geur, dat onoplosbaar is in water. Het gas is uiterst ontvlambaar en pyrofoor. Het ontbrandt bijgevolg spontaan wanneer het in aanraking met lucht komt:
Silaan
| ||||
| Structuurformule en molecuulmodel | ||||
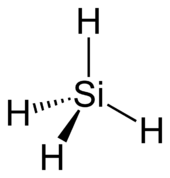 | ||||
Structuurformule van silaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | SiH4 | |||
| IUPAC-naam | silaan | |||
| Andere namen | siliciumtetrahydride, monosilaan, silicaan | |||
| Molmassa | 32,11726 g/mol | |||
| CAS-nummer | 7803-62-5 | |||
| Beschrijving | Kleurloos gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H220 - H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P377 - P381 - P403 | |||
| Opslag | Brandveilig en gescheiden van oxiderende stoffen. | |||
| VN-nummer | 2203 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,35 g/cm³ | |||
| Smeltpunt | −185 °C | |||
| Kookpunt | −112 °C | |||
| Zelfontbrandings- temperatuur | 21 °C | |||
| Onoplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 0 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfG | −1615 kJ/mol | |||
| ΔfH | 283 kJ/mol | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Silaan is het meest eenvoudige uit de stofklasse der silanen en kan beschouwd worden als het siliciumanaloog van methaan.
Synthese
Silaan wordt in laboratoria meestal bereid uit een reactie van magnesiumsilicide en zoutzuur.
Industrieel wordt silaan bereid door eerst silicium te laten reageren met zoutzuur, zodat trichloorsilaan wordt verkregen:
Vervolgens wordt trichloorsilaan verwarmd in een katalytisch bad en ontstaan silaan en siliciumtetrachloride:
Toepassingen
Silaan wordt onder andere toegepast bij het etsen van dragers voor DNA-chips (DNA-microarray), bij het aanbrengen van glasvezels op een polymere drager en ter bescherming van metselwerk.
Toxicologie en veiligheid
De stof kan spontaan ontbranden bij contact met lucht. De stof ontleedt bij verhitting of bij verbranding, met vorming van silicium en waterstof, die brand- en ontploffingsgevaar veroorzaken. Silaan is een sterk reductiemiddel en reageert met oxiderende stoffen. De stof reageert traag met water (hydrolyseert), met kaliumhydroxide en halogenen.
De stof is irriterend voor de ogen, de huid en de luchtwegen. Snelle verdamping van de vloeistof kan bevriezing veroorzaken.

