Paraldehyde
Paraldehyde is het cyclisch trimeer van aceetaldehyde, met als brutoformule C6H12O3. Structureel gezien is het een derivaat van trioxaan. De stof komt voor als een kleurloze vloeistof met een kenmerkende geur. Ze is quasi-onoplosbaar is water, maar zeer goed in ethanol.
Paraldehyde
| ||||
| Structuurformule en molecuulmodel | ||||
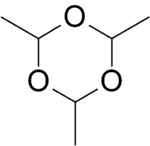 | ||||
Structuurformule van paraldehyde | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C6H12O3 | |||
| IUPAC-naam | 2,4,6-trimethyl-1,3,5-trioxaan | |||
| Andere namen | p-aceetaldehyde, paraceetaldehyde | |||
| Molmassa | 132,16 g/mol | |||
| SMILES | CC1OC(C)OC(C)O1 | |||
| InChI | 1S/C6H12O3/c1-4-7-5(2)9-6(3)8-4/h4-6H,1-3H3 | |||
| CAS-nummer | 123-63-7 | |||
| EG-nummer | 204-639-8 | |||
| Beschrijving | Kleurloze vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H226 | |||
| EUH-zinnen | geen | |||
| P-zinnen | geen | |||
| Opslag | Brandveilig. Gescheiden van voeding, voedingsmiddelen, basen en oxiderende stoffen. | |||
| EG-Index-nummer | 605-004-00-1 | |||
| VN-nummer | 1264 | |||
| ADR-klasse | Gevarenklasse 3 | |||
| LD50 (ratten) | (inhalatie) 2000 ppm (oraal) 1530 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,99 g/cm³ | |||
| Smeltpunt | 12,6 °C | |||
| Kookpunt | 124,5 °C | |||
| Vlampunt | (gesloten vat) 24 °C | |||
| Zelfontbrandings- temperatuur | 235 °C | |||
| Dampdruk | (bij 20°C) 1000 Pa | |||
| Oplosbaarheid in water | (bij 13°C) 120 g/l | |||
| Goed oplosbaar in | ethanol | |||
| Onoplosbaar in | water | |||
| log(Pow) | 0,67 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Paraldehyde wordt in de geneeskunde gebruikt als slaapmiddel en anti-epilepticum; in de industrie en laboratoria als oplosmiddel.
Synthese
Paraldehyde werd voor het eerst gesynthetiseerd in 1829 door Wildenbusch.[1] De stof wordt bereid door middel van een cyclisatie van 3 aceetaldehyde-moleculen, met zwavelzuur als katalysator. Deze reactie is zeer temperatuurgevoelig: ze gaat goed door bij kamertemperatuur, terwijl er bij temperaturen rond −10 °C het tetramere metaldehyde ontstaat. Hieronder staat dit reactieproces voorgesteld:
- Synthese van paraldehyde.
Structuurisomerie
Theoretisch gezien zijn er 4 structuurisomeren van paraldehyde mogelijk. Slechts 2 van deze 4 kunnen werkelijk bestaan. Structuur 1 en 2 zijn respectievelijk bekend onder de naam cis- en trans-paraldehyde. Structuren 3 en 4 kunnen niet bestaan omwille van sterische hindering. De axiale methylgroepen staan namelijk op een afstand, die kleiner is dan de vanderwaalsstraal (zogenaamde gauche-interactie).[2][3]
Medische toepassingen

Paraldehyde wordt veelvuldig in de geneeskunde gebruikt. Ze is verkrijgbaar in ampullen van 5 ml. De eerste klinische toepassingen van deze stof werden gedaan door Vincenzo Cervello in 1882.[1]
Slaapmiddel
De slaapverwerkkende effecten van de stof werden in 1887 per toeval ontdekt door Eugen Baumann en Alfred Kast.[1] Het werd aanvankelijk gebruikt om personen met een delirium tremens in slaap te krijgen. Dit wordt nu door middel van andere geneesmiddelen gedaan. Paraldehyde is een van de veiligste slaapmiddelen en het werd tot in de jaren '60 van de 20ste eeuw gebruikt om personen in psychiatrische en geriatrische instellingen in slaap te krijgen.
Anti-epilepticum
Paraldehyde is tevens een middel tegen epilepsie. In tegenstelling met diazepam en andere benzodiazepines, onderdrukt paraldehyde de ademhaling niet, zodat deze stof veel veiliger is in gebruik.[4] Aangezien de dosering tussen anti-epilepticum en slaapmiddel vrij klein is, en, in geval van nood, dus moeilijk te doseren, resulteert het toedienen van de stof meestal in een slaap.
Toxicologie en veiligheid
De stof ontleedt onder invloed van lucht en licht. Ze ontleedt ook bij verhitting, met vorming van giftige dampen. Paraldehyde reageert met basen en oxiderende stoffen en ze tast kunststof aan.
De stof is irriterend voor de ogen, de huid en de luchtwegen. Ze kan effecten hebben op het centraal zenuwstelsel.
Bij langdurige of herhaalde blootstelling kunnen er ook effecten op de nieren en de lever optreden, met als gevolg een verstoorde werking.
Zie ook
Externe links

- (en) Gegevens van Paraldehyde in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van paraldehyde
- (en) Data-sheet van paraldehyde
Bronnen, noten en/of referenties
|
