Koper(I)chloride
Koper(I)chloride is een koperzout van waterstofchloride, met als brutoformule CuCl. De stof komt in zuivere toestand voor als een witte kristallijne vaste stof, die slecht oplosbaar is in water. Door oxidatie van koper(I) tot koper(II) onder invloed van luchtzuurstof worden de witte kristallen na verloop van tijd geelgroen.
Koper(I)chloride
| ||||
| Structuurformule en molecuulmodel | ||||
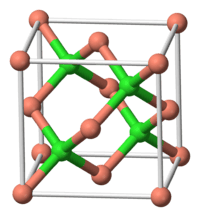 | ||||
Kristalstructuur van koper(I)chloride | ||||
-chloride-sample.jpg) | ||||
Koper(I)chloride-kristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CuCl | |||
| IUPAC-naam | koper(I)chloride | |||
| Andere namen | kopermonochloride | |||
| Molmassa | 98,99 g/mol | |||
| SMILES | Cl[Cu] | |||
| InChI | 1/ClH.Cu/h1H;/q;+1/p-1/fCl.Cu/h1h;/q-1;m | |||
| CAS-nummer | 7758-89-6 | |||
| EG-nummer | 231-842-9 | |||
| PubChem | 62652 | |||
| Beschrijving | Wit tot lichtgroen poeder | |||
| Vergelijkbaar met | koper(I)bromide, koper(I)jodide, koper(II)chloride | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H410 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P501 | |||
| EG-Index-nummer | 029-001-00-4 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vaste stof | |||
| Dichtheid | 4,14 g/cm³ | |||
| Smeltpunt | 426 °C | |||
| Kookpunt | (ontleedt) 1490 °C | |||
| Oplosbaarheid in water | 0,62 g/l | |||
| Goed oplosbaar in | di-ethylether, pyridine, acetonitril | |||
| Slecht oplosbaar in | water | |||
| Onoplosbaar in | ethanol, aceton | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | kubisch | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Koper(I)chloride komt in de natuur voor als het mineraal nantokiet.
Synthese
Koper(I)chloride wordt gevormd wanneer koper in een waterstofchloride-oplossing geplaatst wordt. Op het koperoppervlak ontstaat een witgroene aanslag van koper(I)chloride.
Daarnaast wordt het bereid door reductie van koper(II)chloride met natriumsulfiet:
Op industriële schaal wordt het bereid door reactie van koper met chloorgas:
Eigenschappen
Koper(I)chloride is een Lewis-zuur en wordt volgens het HSAB-principe geclassificeerd als zacht. Zo is het in staat om te complexeren met amines en fosfines, zoals trifenylfosfine:
Het lost zeer moeilijk op in water, maar wanneer geschikte donoren (zoals halogeniden) aanwezig zijn, verhoogt de oplosbaarheid sterk. Zo lost koper(I)chloride wel goed op in een geconcentreerde oplossing van natriumchloride. Aanwezigheid van cyanide, ammoniak of thiosulfaat zorgt eveneens voor een verhoogde oplosbaarheid. Complexen met dienen, zoals 1,5-cyclo-octadieen, zijn uitermate stabiel.
Koper(I)chloride kan als oplossing in ammoniak koolstofmonoxide absorberen, door vorming van een complex:
Ethyn ondergaat een vergelijkbare absorptiereactie.
Toepassingen
Koper(I)chloride worden onder andere gebruikt als katalysator in talrijke organische reacties, zoals de Sandmeyer-reactie. Het reageert met methyllithium tot het overeenkomstig Gilmanreagens. Daarnaast is koper(I)chloride een katalysator bij de atoomtransfer radicalaire polymerisatie (ATRP).
Zie ook
Externe links
- (en) MSDS van koper(I)chloride
- (en) Gegevens van Koper(I)chloride in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)

