Eiwitstructuur
Een eiwitstructuur of proteïnestructuur is de ruimtelijke moleculaire structuur van een eiwitmolecuul. Elk eiwit is een polymeer – meer gespecificeerd een polypeptide – bestaande uit L-α-aminozuren. Het eiwit vouwt zich in een specifieke, driedimensionale structuur onder invloed van non-covalente interacties, zoals waterstofbruggen, ionaire bindingen en vanderwaalskrachten. De vouwing wordt bepaald door de onderlinge aantrekking en afstoting van de verschillende aminozuren en door de omgeving waarin het eiwit zich bevindt. Er zijn ook enzymen die eiwitten helpen zich te vouwen in de juiste vorm. De vorm van een eiwit is bepalend voor de functie van het eiwit. Hierbij is het van belang dat het eiwit zich goed opvouwt. Wanneer dit niet gebeurt werkt het eiwit niet goed, en kan het in uitzonderlijke gevallen zelfs andere effecten veroorzaken, zoals bij de ziekte van Creutzfeldt-Jakob.
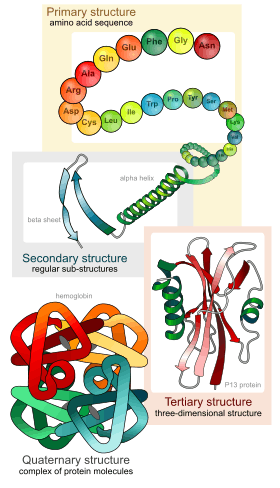
Structuren
De vorm waarin een eiwit zich normaal vouwt, wordt de natieve conformatie genoemd.
Conventionele indeling
Conventioneel worden de volgende aspecten van de structuur van een eiwit onderscheiden:
- Primaire structuur: de aminozuursequentie, de keten wordt bij elkaar gehouden door covalente bindingen, de peptidebinding. Er zijn 20 verschillende standaardaminozuren en een eiwit kan makkelijk uit enkele duizenden aminozuren bestaan.

- Secundaire structuur: de lokale vouwing in driedimensionale structuurelementen, zoals de α-helix en de β-sheet. Deze structuurelementen worden vooral gestabiliseerd door middel van waterstofbruggen tussen de ruggengraat van de proteïne.
- Tertiaire structuur: de vouwing van het eiwit als geheel. Stabilisatie treedt op door aantrekkingskrachten tussen de zijketens van de ingebouwde aminozuren, zoals hydrofobe interacties, ion-interacties en zwavelbruggen.
- Quaternaire structuur: de vorm die voortkomt uit de associatie van meerdere eiwitketens, het eiwitcomplex. Een voorbeeld hiervan is hemoglobine, dat uit meerdere eiwitketens bestaat en ook nog eens in het midden een heem bevat.
Driedimensionale structuren
Voor het begrijpen van de functie van een eiwit op moleculair niveau is het vaak noodzakelijk hun driedimensionale structuur vast te stellen. Het onderzoek hiernaar gebeurt in de structuurbiologie, waar voor het onderzoek gebruikgemaakt wordt van röntgendiffractie, NMR-spectroscopie en duale polarisatie-interferometrie.
Eiwitstructuren bestaan uit enkele tientallen tot duizenden aminozuren.[1] Eiwitten worden ingedeeld naar hun fysieke grootte in nanodeeltjes (definitie: 1–100 nm). Zeer grote aggregaties kunnen gevormd worden uit subeenheden. Zo worden met vele duizenden actinemoleculen een microfilament gevormd.
Conformaties
Alhoewel eenzelfde eiwit kan voorkomen in verschillende stabiele laag-energetische conformaties, heeft elke conformatie zijn eigen specifieke biologische activiteit. Van deze conformaties wordt normaal gezien slechts één conformatie als biologisch actief beschouwd. Behalve de genoemde structuurniveaus kunnen proteïnen ook veranderen tussen deze verschillende conformaties.
Uiteinden eiwitketen
Wanneer gerefereerd wordt aan de uiteinden van een eiwitketen, betreft het meestal de stikstof- of N-terminus (begin van de eiwitketen) en koolstof- of C-terminus (einde van de eiwitketen), genoemd naar de functionele groep aan de uiteinden.
Domeinen, motieven en vouwing van eiwitstructuren

Eiwitten bestaan uit verscheidene structurele eenheden:
- Een eiwitdomein is een element van de gehele eiwitstructuur dat zich zelf stabiliseert en vaak onafhankelijk van de rest van de eiwitketen vouwt. Veel domeinen zijn niet uniek voor het door een gen of familie van genen gecodeerde eiwit en komen voor in een veel verschillende eiwitten. Domeinen worden vaak genoemd en onderscheiden naar de biologische functie van het eiwit waar ze in voorkomen, bijvoorbeeld het calcium-bindingdomein van calmoduline. Omdat ze op zichzelf stabiel zijn kunnen domeinen voor het met genetische technologie te maken chimaeras overgebracht worden van het ene naar het andere eiwit.
- Structuurmotieven en sequentiemotieven zijn korte segmenten in de driedimensionale structuur bij een structuurmotief of in aminozuursequenties bij een sequentiemotief, die in verschillende eiwitten in groten getale voorkomen.
- De supersecundaire structuur is een specifieke combinatie van secundaire structuurelementen, zoals de bèta-alfa-bèta-eenheden of het helix-draai-helix-motief. Sommigen worden ook wel aangeduid als structuurmotieven.
- Eiwitvouwing is de algemene eiwitarchitectuur, zoals de helixbundel (bijvoorbeeld bij het bromodomein), beta-barrel, Rossmann-vouwing of naar de verschillende vouwingen genoemd in de Structural Classification of Proteins database (SCOP).[2][3]
Ondanks het feit dat er ongeveer 100.000 verschillende eiwitten voorkomen in eukaryoten, zijn er veel minder verschillende domeinen, structuurmotieven en eiwitvouwingen.
Zie ook
Bronnen, noten en/of referenties
|
.png)