Dichloordifenyltrichloorethaan
Dichloordifenyltrichloorethaan of DDT is een organisch chemisch insecticide met als brutoformule C14H9Cl5. Het is een vaste stof die weinig tot slecht oplosbaar is in de courante organische oplosmiddelen.
DDT
| |||||
| Structuurformule en molecuulmodel | |||||
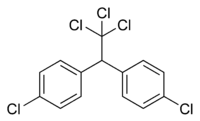 | |||||
Structuurformule van DDT | |||||
 | |||||
Molecuulmodel van DDT | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C14H9Cl5 | ||||
| IUPAC-naam | 4,4'-(2,2,2-trichloroethaan-1,1-diyl)bis(chloorbenzeen) | ||||
| Molmassa | 354,49 g/mol | ||||
| SMILES | ClC(Cl)(Cl)C(C1=CC=C(Cl) C=C1)C2=CC=C(Cl)C=C2 | ||||
| CAS-nummer | 50-29-3 | ||||
| EG-nummer | 200-024-3 | ||||
| PubChem | 3036 | ||||
| Vergelijkbaar met | dicofol | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H351 - H372 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P273 - P281 - P301+P310 - P314 - P501 | ||||
| Carcinogeen | mogelijk (IARC-klasse 3)[1] | ||||
| Omgang | Niet inademen, contact vermijden | ||||
| EG-Index-nummer | 602-045-00-7 | ||||
| MAC-waarde | 1 mg/m³ | ||||
| LD50 (ratten) | (oraal) 87 mg/kg (huid) 1931 mg/kg (intraperitoneaal) 9,100 mg/kg (subcutaan) 1500 mg/kg | ||||
| LD50 (konijnen) | (oraal) 150 mg/kg (huid) 300 mg/kg (subcutaan) 250 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Dichtheid | 0,99 g/cm³ | ||||
| Smeltpunt | 108,5 °C | ||||
| Kookpunt | 260 °C | ||||
| Dampdruk | 2,3 × 10−5 Pa | ||||
| Oplosbaarheid in water | 3 × 10−6 g/l | ||||
| Slecht oplosbaar in | aceton, cyclohexaan, 1,4-dioxaan | ||||
| Onoplosbaar in | water | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
DDT werd voor het eerst in 1874 door de Duitse chemicus Othmar Zeidler gemaakt. De werkzaamheid als insecticide werd pas in 1939 ontdekt door de Zwitser Paul Hermann Müller, die in dienst was bij J.R. Geigy AG.
Toepassingen, toxicologie en veiligheid
DDT heeft een toxische werking op luizen, bedwantsen, vlooien, muggen en vele andere insecten. Het dodelijk effect op luizen is bijzonder waardevol omdat deze plaaginsecten een zeer gevaarlijke ziekte verspreiden, vlektyfus. Maar ook vele insecten die nuttig zijn voor de mens (bijvoorbeeld insecten die schadelijke insecten doden) worden door DDT gedood. Zoals bij veel andere insecticiden leidt DDT tot de ontwikkeling van resistentie bij vele insecten.
Terwijl de ontdekker van DDT, Paul Hermann Müller, hiervoor in 1948 nog werd beloond met de Nobelprijs, deed het boek Silent Spring (Dode lente) van de Amerikaanse biologe Rachel Carson de publieke opinie in 1962 inzien hoe schadelijk DDT is voor het milieu. Door de slechte afbreekbaarheid en de schadelijkheid voor mens en dier door ophoping in vetten is het gebruik van DDT tegenwoordig verboden in de westerse wereld. In de derde wereld echter wordt op heden nog steeds DDT gebruikt, met name voor de bestrijding van malaria.[2]
Gebruik van kleine hoeveelheden DDT tegen malaria door het besproeien van muren in huizen is vaak nog steeds succesvol (met uitblijven van schadelijke effecten op mens en milieu) gezien de daling van malariatransmissie tot 90% die er op volgt; het gebruik van DDT wordt daarom weer aanbevolen door de Wereldgezondheidsorganisatie (WHO).[3] Ook al gaat de malariamug niet dood van de DDT, de mug verblijft niet graag op met DDT behandelde oppervlakken. De effectiviteit van DDT tegen malariamuggen is sterk verminderd door resistentie, die vooral het gevolg is van grootschalig gebruik in de landbouw.[4]
Gebruik in de landbouw wordt afgeraden in verband met de effecten op het milieu. DDT-vervuiling is tegenwoordig zo wijd verspreid dat het zelfs te vinden is in het vet van pinguïns op Antarctica. Dit komt ook omdat het accumuleert in de voedselketen: predatoren verzamelen de DDT in het lichaamsvet van hun prooidieren, en bij meertrapspredatie kan de DDT uiteindelijk aan de top van de voedselketen (ijsberen, roofvogels, mensen) tot schadelijke concentraties accumuleren.
DDT is zo persistent dat het in alle landen in vrij grote hoeveelheden in moedermelk voorkwam. Na beperking van het gebruik zijn de niveaus wereldwijd aanzienlijk gedaald, maar nog niet verdwenen. In streken waar DDT niet verboden is, liggen de niveaus vaak nog steeds hoger dan door de WHO veilig wordt geacht.[5]
Commerciële samenstelling
DDT als commercieel product bestaat uit een mengsel van isomeren en metabolieten, onder andere:
- 70% 4,4'-DDT (4,4' dichloor-difenyl-trichloorethaan)
- 15% 2,4'-DDT
- 5% 4,4'-DDD (4,4' dichloor-difenyl-dichloorethaan)
| 4,4'DDT | 2,4'DDT | 4,4'DDD | ||
|---|---|---|---|---|
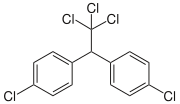 | 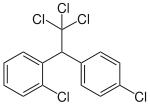 |  |
Daarnaast komen er nog enkele andere verbindingen in kleinere hoeveelheden voor.
Externe link
| Zie de categorie DDT van Wikimedia Commons voor mediabestanden over dit onderwerp. |
Bronnen, noten en/of referenties
|


