Zuurstofdifluoride
Zuurstofdifluoride (ook wel zuurstofhypofluoriet genoemd) is een anorganische verbinding met als brutoformule OF2. Zoals voorspeld door de VSEPR-theorie neemt de molecule een gebogen geometrie aan, vergelijkbaar met water. Zuurstofdifluoride komt voor als een kleurloos gas en is een sterke oxidator.
Zuurstofdifluoride
| |||||
| Structuurformule en molecuulmodel | |||||
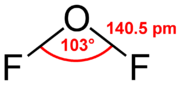 | |||||
Structuurformule van zuurstofdifluoride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | OF2 | ||||
| IUPAC-naam | zuurstofdifluoride | ||||
| Andere namen | zuurstoffluoride, difluoroxide, zuurstofhypofluoriet | ||||
| Molmassa | 53,996206 g/mol | ||||
| SMILES | O(F)F | ||||
| InChI | 1S/F2O/c1-3-2 | ||||
| CAS-nummer | 7783-41-7 | ||||
| EG-nummer | 231-996-7 | ||||
| PubChem | 24547 | ||||
| Beschrijving | Kleurloos giftig gas | ||||
| Vergelijkbaar met | dizuurstofdifluoride, difluoramine | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| LD50 (ratten) | 2,6 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | gasvormig | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 1,9 g/cm³ | ||||
| Smeltpunt | −223,8 °C | ||||
| Kookpunt | −144,8 °C | ||||
| Dampdruk | > 101.325 Pa | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
Zuurstofdifluoride werd voor het eerst gemeld in 1929 en werd verkregen door de elektrolyse van gesmolten kaliumfluortantalaat en waterstoffluoride met kleine hoeveelheden water.
Tegenwoordig wordt de stof bereid door reactie van difluor met een verdunde waterige oplossing van natriumhydroxide, waarbij natriumfluoride als nevenproduct wordt gevormd:
Eigenschappen en reacties
De krachtige oxiderende eigenschappen van zuurstofdifluoride zijn toe te schrijven aan het oxidatiegetal +II voor het zuurstofatoom. Dit is immers hoogst ongebruikelijk: normaal neemt zuurstof oxidatiegetal -II aan. De reden hiervoor ligt in het feit dat fluor veel elektronegatiever is dan zuurstof en bijgevolg de elektronenwolk rond zuurstof ingrijpend polariseert.
Boven 200°C ontleedt zuurstofdifluoride in elementair zuurstof en difluor via een radicalair mechanisme.
Zuurstofdifluoride reageert met vele metalen, waarbij oxiden en fluoriden gevormd worden. Niet-metalen en xenon kunnen er ook mee reageren:
- fosfor reageert tot fosforpentafluoride en fosforylfluoride (POF3)
- zwavel reageert tot zwaveldioxide en zwaveltetrafluoride
- xenon reageert tot xenontetrafluoride
Zuurstofdifluoride reageert zeer traag met water tot waterstoffluoride:
Zuurstofdifluoride oxideert zwaveldioxide tot zwaveltrioxide:
Echter, in de aanwezigheid van UV-straling worden sulfurylfluoride (SO2F2) en pyrosulfurylfluoride (S2O5F2) gevormd:
Toxicologie en veiligheid
Zuurstofdifluoride is een gevaarlijke stof, zoals ieder sterk oxiderende gas. Het is zeer toxisch bij inhalatie en corrosief voor huid en ogen. Contact met het gas kan roodheid, jeuk, brandwonden en ademhalingsproblemen veroorzaken. Het kan exploderen indien het in contact met water komt.


