Dizuurstofdifluoride
Dizuurstofdifluoride is een anorganische verbinding tussen zuurstof en fluor, met als brutoformule O2F2. Bij standaardomstandigheden komt het voor als een bruin gas; in vloeibare vorm is het rood en in vaste vorm oranje.
Dizuurstofdifluoride
| ||||
| Structuurformule en molecuulmodel | ||||
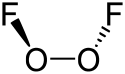 | ||||
Structuurformule van dizuurstofdifluoride | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | F2O2 | |||
| IUPAC-naam | dizuurstofdifluoride | |||
| Andere namen | fluorperoxide | |||
| Molmassa | 69,995606 g/mol | |||
| SMILES | O(OF)F | |||
| InChI | 1S/F2O2/c1-3-4-2 | |||
| CAS-nummer | 7783-44-0 | |||
| PubChem | 123257 | |||
| Vergelijkbaar met | zuurstofdifluoride | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | bruin | |||
| Dichtheid | (bij −57°C) 1,45 g/cm³ | |||
| Smeltpunt | −163,5 °C | |||
| Kookpunt | −57 °C | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
De eerste synthese van de stof werd uitgevoerd door Otto Ruff en Walter Menzel in 1933.[1] Dit gebeurde met behulp van een elektrische ontlading in een gasmengsel van zuurstof en fluor:
De reactie grijpt plaats bij zeer lage temperatuur en druk (−183 °C en 15-20 mm Hg).
Vloeibaar dizuurstofdifluoride wordt gevormd door een zuurstofgas-difluormengsel te verhitten tot 700 °C en dan snel af te koelen op de buitenwand van een roestvrijstalen buis die gekoeld wordt met vloeibare zuurstof.[2]
Dizuurstofdifluoride ontstaat ook door fotosynthese (bestraling van een vloeibaar mengsel van zuurstof en fluor bij −196 °C met ultraviolet licht).[3]
Eigenschappen
Dizuurstofdifluoride is instabiel en ontleedt vanaf −95 °C. Het is een sterke oxidator en een fluoreringsmiddel.
Toepassingen
Dizuurstofdifluoride wordt gebruikt als fluoreringsmiddel, bijvoorbeeld om de hexafluoriden van neptunium of plutonium bij lage temperatuur te vormen. Neptunium(VI)fluoride ontstaat door de reactie van dizuurstofdifluoride met neptunium(IV)oxide of neptunium(IV)fluoride:[4]
Dizuurstofdifluoride wordt ook gebruikt om dioxygenylzouten te vormen, die het O2+-ion bevatten, zoals O2BF4 en O2PF6:[5]
Bronnen, noten en/of referenties
|