Fosforpentafluoride
Fosforpentafluoride (PF5) is een fosforhalogenide dat onder standaardomstandigheden voorkomt als een kleurloos gas.[1]
Fosforpentafluoride
| |||||
| Structuurformule en molecuulmodel | |||||
 | |||||
Structuurformule van fosforpentafluoride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | PF5 | ||||
| IUPAC-naam | fosforpentafluoride | ||||
| Andere namen | fosfor(V)fluoride, pentafluorfosforaan | ||||
| Molmassa | 125,966 g/mol | ||||
| CAS-nummer | 7647-19-0 | ||||
| PubChem | 24295 | ||||
| Vergelijkbaar met | fosforpentachloride, fosforpentabromide, fosforpentajodide | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H280 - H314 - H330 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | geen | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | gasvormig | ||||
| Kleur | kleurloos | ||||
| Smeltpunt | −93,78 °C | ||||
| Kookpunt | −84,6 °C | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 0 D | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
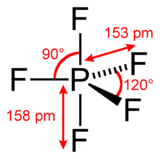
Structuur
Fosforpentafluoride is een hypervalente verbinding. Röntgendiffractie aan een éénkristal toont aan dat in fosforpentafluoride twee duidelijk van elkaar verschillende fosfor-fluorbindingen voorkomen, namelijk axiale en equatoriale bindingen: P−Fax = 158,0 pm en P−Feq = 152,2 pm. Via elektronendiffractie in de gasfase worden vergelijkbare resultaten gevonden: P−Fax = 158 pm en P−Feq = 153 pm.
Met behulp van 19F-NMR is het niet mogelijk, zelfs niet bij −100°C, onderscheid te maken tussen de axiale en equatoriale fluoratomen. De schijnbare equivalentie van de fluoratomen is terug te voeren op de snelle pseudorotatie via het Berry-mechanisme, waardoor de axiale en equatoriale fluoratomen zeer snel van positie wisselen. Deze schijnbare gelijkwaardigheid van de fluoratomen in fosforpentafluoride werd voor het eerst opgemerkt in 1953.[2] Het verschijnsel werd voor het eerst verklaard door R. Stephen Berry, naar wie het mechanisme vervolgens genoemd is. De Berry-pseudorotatie heeft geen meetbaar effect op het 19F-NMR-spectrum van fosforpentafluoride omdat NMR meet op een tijdbasis van een milliseconde. De uitwisseling van de twee posities gaat veel sneller: in het NMR-spectrum is dus enkel een gemiddeld signaal meetbaar. Elektronendiffractie en röntgendiffractie hebben geen last van het verschijnsel, omdat zij beide op een veel kortere tijdschaal werken.
Bronnen, noten en/of referenties
|


