Tetramethylammoniumchloride
Tetramethylammoniumchloride is een quaternair ammoniumzout met als brutoformule C4H12NCl. De stof komt voor als witte, hygroscopische kristallen, die zeer goed oplosbaar zijn in water.
Tetramethylammoniumchloride
| ||||
| Structuurformule en molecuulmodel | ||||
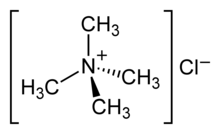 | ||||
Structuurformule van tetramethylammoniumchloride | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C4H12NCl | |||
| IUPAC-naam | tetramethylammoniumchloride | |||
| Andere namen | N-,N-,N-trimethylmethanamiumchloride, tetraminechloride | |||
| Molmassa | 109,59778 g/mol | |||
| SMILES | C[N+](C)(C)C.[Cl-] | |||
| CAS-nummer | 75-57-0 | |||
| Beschrijving | Witte kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H300 - H311 - H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P264 - P280 - P301+P310 - P305+P351+P338 - P312 | |||
| Opslag | Gescheiden van oxiderende stoffen. Droog en goed gesloten bewaren. | |||
| VN-nummer | 2811 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| LD50 (ratten) | (oraal) 50 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,17 g/cm³ | |||
| Smeltpunt | 425 °C | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Tetramethylammoniumchloride wordt bereid door een alkylering van ammoniumchloride met dimethylcarbonaat:[1]
Toepassingen
Tetramethylammoniumchloride wordt gebruikt als additief in polymerase-kettingreacties (PCR), om het rendement te verhogen. Het kent ook toepassingen als oppervlakte-actieve stof. De stof is, net als ammoniumchloride, een zout. Het voordeel van het tetramethylzout ten opzichte van ammoniumchloride zelf is dat het niet zuur-base-actief is. Ook in de vorming van complexen is tetramethylammoniumchloride niet betrokken.
De stof wordt gebruikt als katalysator in bepaalde organische reacties, bijvoorbeeld de reactie van fenol of cresol met fosgeen tot carbonaatesters zoals difenylcarbonaat.[2] Tetramethylammoniumchloride is een polymerisatieversneller voor de polymerisatie van caprolactam tot nylon 6.[3]
Verder wordt het aangewend als reagens voor de productie van herbiciden.[4]
Tetramethylammoniumchloride is een uitgangsproduct voor de bereiding van tetramethylammoniumhydroxide door elektrolyse.[5]
Toxicologie en veiligheid
De stof ontleedt bij verhitting boven 300°C met vorming van ammoniak, koolstofmonoxide, waterstofchloride en stikstofoxiden. Tetramethylammoniumchloride reageert met oxiderende stoffen.
De stof is irriterend voor de ogen, de huid en de luchtwegen. Ze kan effecten hebben op het centraal zenuwstelsel, met als gevolg duizeligheid en een verminderd bewustzijn.
Externe links

- (en) MSDS van tetramethylammoniumchloride
