Dimethylcarbonaat
Dimethylcarbonaat (DMC) is een kleurloze vloeistof met een kenmerkende geur.
Dimethylcarbonaat
| ||||
| Structuurformule en molecuulmodel | ||||
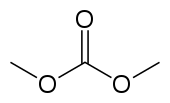 | ||||
Structuurformule van dimethylcarbonaat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C3H6O3 | |||
| IUPAC-naam | dimethylcarbonaat | |||
| Andere namen | methylcarbonaat; DMC | |||
| Molmassa | 90,1 g/mol | |||
| SMILES | COC(=O)OC | |||
| CAS-nummer | 616-38-6 | |||
| EG-nummer | 210-478-4 | |||
| PubChem | 12021 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225[1] | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210[1] | |||
| EG-Index-nummer | 607-013-00-6 | |||
| VN-nummer | 1161 | |||
| ADR-klasse | Gevarenklasse 3 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,07 g/cm³ | |||
| Smeltpunt | 3 °C | |||
| Kookpunt | 90 °C | |||
| Vlampunt | 18 °C | |||
| Zelfontbrandings- temperatuur | 458 °C | |||
| Dampdruk | 7400 Pa | |||
| Oplosbaarheid in water | 139 g/l | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Er zijn verschillende manieren om dimethylcarbonaat te verkrijgen, waaronder:
- de reactie van methanol met fosgeen; dit is een route die niet meer commercieel gebruikt wordt omwille van het giftige fosgeen. Er wordt ook corrosief waterstofchloride gevormd:
- 2 CH3OH + COCl2 → CH3-O-(C=O)-O-CH3 + 2 HCl
- de reactie van methanol, zuurstof en koolstofmonoxide. Dit is de moderne manier voor de productie van de stof, en vermijdt het gebruik van giftig fosgeen.[2] De reactietemperatuur is ongeveer 120 tot 130°C, de druk 20 tot 30 atmosfeer. Als katalysator wordt een koperzout gebruikt.[3] Het bijproduct is water:
- 2 CH3OH + CO + 1/2 O2 → CH3-O-(C=O)-O-CH3 + H2O.
Toepassingen
DMC wordt gebruikt in chemische reacties als een methylerings- of carbonyleringsmiddel. Een methylering brengt een methylgroep (-CH3) in een molecule aan; een carbonylering brengt een carbonylgroep (C=O) aan. DMC wordt beschouwd als een "groen" reagens omdat het niet giftig is en weinig impact op het milieu heeft.[4]
Dimethylcarbonaat kan gebruikt worden als een oplosmiddel in verven en coatings, of als een brandstofadditief.
Eigenschappen
Het is een licht ontvlambare vloeistof. De damp is zwaarder dan lucht, en kan zich langs de grond verspreiden; ontsteking op afstand is mogelijk. De damp kan een ontplofbaar mengsel vormen met lucht.
Externe link
Bronnen, noten en/of referenties
|
