Natriumwaterstofsulfiet
Natriumwaterstofsulfiet of natriumbisulfiet (NaHSO3) is het mononatriumzout van zwaveligzuur. De stof komt, in zuivere toestand, voor als een witte vaste stof, maar aangezien ze enkel kan bestaan in een oplossing, is het een kleurloze tot gele vloeistof, die goed mengbaar is met water. Dit zout wordt gebruikt als voedingsadditief en draagt het E-nummer E222.
Natriumwaterstofsulfiet
| ||||
| Structuurformule en molecuulmodel | ||||
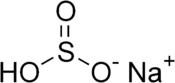 | ||||
Structuurformule van natriumwaterstofsulfiet | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | NaHSO3 | |||
| IUPAC-naam | natriumwaterstofsulfiet | |||
| Andere namen | natriumbisulfiet | |||
| Molmassa | 104,06 g/mol | |||
| CAS-nummer | 7631-90-5 | |||
| PubChem | 656672 | |||
| Beschrijving | Witte vaste stof | |||
| Vergelijkbaar met | kaliumwaterstofsulfiet, calciumwaterstofsulfiet | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H318 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 | |||
| Opslag | Gescheiden van sterk oxiderende stoffen en sterke zuren. | |||
| EG-Index-nummer | 016-064-00-8 | |||
| LD50 (ratten) | (oraal) 1540 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,48 g/cm³ | |||
| Smeltpunt | 150 °C | |||
| Oplosbaarheid in water | 420 g/l | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Natriumwaterstofsulfiet kan worden bereid door een reactie van natriummetabisulfiet met water:
Toepassingen
Natriumwaterstofsulfiet heeft verschillende toepassingen in de organische chemie. Het vormt adducten met aldehyden en met sommige cyclische ketonen tot sulfonzuur.[1]
Het is tevens een sleutelingrediënt in de Bucherer-reactie, de reversibele conversie van 2-naftol (1) naar naftylamine (2) in de aanwezigheid van ammonia en natriumwaterstofsulfiet:
 Algemeen verloop van de Bucherer-reactie.
Algemeen verloop van de Bucherer-reactie.
Ook in de Bucherer-carbazoolsynthese, een synthesemethode om carbazolen (3) te bereiden uit naftolen (1) en arylhydrazines (2), wordt gebruikgemaakt van natriumwaterstofsulfiet:
 Algemeen verloop van de Bucherer-carbazoolsynthese.
Algemeen verloop van de Bucherer-carbazoolsynthese.
Natriumwaterstofsulfiet wordt ook gebruikt als ontkleuringsmiddel in bepaalde zuiveringsreacties, omdat het een sterke reductor is en gekleurde sterke oxidatoren kan reduceren.
Externe links
Bronnen, noten en/of referenties
|

