Natriumaluminiumhydride
Natriumaluminiumhydride is een anorganische ionaire verbinding van natrium, aluminium en waterstof, met als brutoformule NaAlH4. De stof komt voor als hygroscopische en corrosieve witte kristallen, die hevig reageren met water. Hierbij komen onder meer natriumhydroxide en waterstofgas vrij:
Natriumaluminiumhydride
| |||||
| Structuurformule en molecuulmodel | |||||
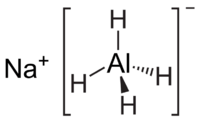 | |||||
Structuurformule van natriumaluminiumhydride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | NaAlH4 | ||||
| IUPAC-naam | natriumaluminiumhydride | ||||
| Andere namen | natriumalanaat, natriumtetrahydridoaluminaat | ||||
| Molmassa | 54,00306788 g/mol | ||||
| SMILES | [Al-]([H])([H])([H])[H].[Na+] | ||||
| InChI | 1S/Al.Na.4H/q-1;+1;;;; | ||||
| CAS-nummer | 13770-96-2 | ||||
| Beschrijving | Witte kristallen | ||||
| Vergelijkbaar met | lithiumaluminiumhydride | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H261 - H302 - H314 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P231+P232 - P280 - P305+P351+P338 - P310 - P422 | ||||
| Hygroscopisch? | ja | ||||
| Opslag | Luchtdicht en goed gesloten bewaren. Zo droog mogelijk opslaan. | ||||
| VN-nummer | 2835 | ||||
| ADR-klasse | Gevarenklasse 4.3 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 0,905 g/cm³ | ||||
| Smeltpunt | 178 °C | ||||
| Vlampunt | −7 °C | ||||
| Goed oplosbaar in | tetrahydrofuraan | ||||
| Geometrie en kristalstructuur | |||||
| Kristalstructuur | monoklien | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Natriumaluminiumhydride is verwant met lithiumaluminiumhydride, een veelgebruikte reductor in zowel organisch als anorganische chemie. Natriumaluminiumhydride heeft daarom vergelijkbare eigenschappen. Het is een licht ontvlambare stof, maar niet reactief in droge lucht en bij kamertemperatuur.
Synthese
Natriumaluminiumhydride kan bereid worden uit reactie van metallisch natrium, aluminium en waterstofgas onder hoge druk en temperatuur:[1]
Het kan ook uit lithiumaluminiumhydride bereid worden, door een metathesereactie met natriumhydride in THF:
Toepassingen
Net zoals lithiumaluminiumhydride is natriumaluminiumhydride een sterke reductor, waarvan de werking gelijkaardig is met die van di-isobutylaluminiumhydride (DIBAL). Doordat de grote substituenten ontbreken is natriumaluminiumhydride minder selectief dan DIBAL. Natrium is ook minder elektronegatief dan lithium, waardoor NAH een grotere reactiviteit heeft.
Externe links
- (en) MSDS van natriumaluminiumhydride
- (en) Gegevens van Natriumaluminiumhydride in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|


