Hexachloorfosfazeen
Hexachloorfosfazeen, hexachloortrifosfazeen of hexachloorcyclotrifosfazeen is een wit, kristallijn poeder, oplosbaar in organische oplosmiddelen. De molecule heeft een ringstructuur met de molecuulformule (NPCl2)3; ze kan dus beschouwd worden als het trimeer van de (niet bestaande) stof NPCl2 (fosfonitrilchloride).
hexachloorfosfazeen
| ||||
| Structuurformule en molecuulmodel | ||||
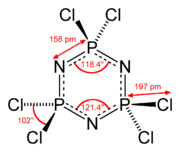 | ||||
Structuurformule van hexachloorfosfazeen | ||||
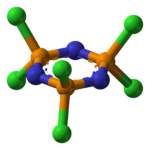 | ||||
Molecuulmodel van hexachloorfosfazeen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | N3P3Cl6 | |||
| IUPAC-naam | hexachloorfosfazeen | |||
| Andere namen | hexachloorcyclotrifosfazeen, 2,2,4,4,6,6-hexachloor-1,3,5-triaza-2,4,6-trifosforine, fosfonitrilchloride trimeer | |||
| Molmassa | 347,66 g/mol | |||
| SMILES | [P]1(=N[P](=N[P](=N1)(Cl)Cl)(Cl)Cl)(Cl)Cl | |||
| CAS-nummer | 940-71-6 | |||
| EG-nummer | 213-376-8 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,98 g/cm³ | |||
| Smeltpunt | 112-115 °C | |||
| Kookpunt | (bij 13 mm Hg) 127 °C | |||
| Goed oplosbaar in | organische oplosmiddelen | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Hexachloorfosfazeen, en in mindere mate analoge ringvormige verbindingen met de algemene formule (NPCl2)n (n = 4, 5...), wordt gevormd door de reactie van fosforpentachloride (PCl5) met ammoniak (NH3) of met ammoniumchloride (NH4Cl):
Deze reactie werd reeds beschreven door Heinrich Rose en Justus von Liebig in 1834, maar pas later werd de chemische formule van het reactieproduct bepaald, en nog later het feit dat de stof een ringvormige structuur heeft.
Toepassing
Hexachloorfosfazeen vormt de basisgrondstof voor een uitgebreide familie van polymeren met anorganische ruggengraat, de zogenaamde polyfosfazenen. Door hexachloorfosfazeen te verwarmen, polymeriseert het via een ringopening tot poly(dichloorfosfazeen). Onderstaande structuur toont een monomeer van een polyfosfazeenpolymeer; in poly(dichloorfosfazeen) zijn R1 en R2 gelijk aan chloor (n kan gaan van 100 tot 15.000):
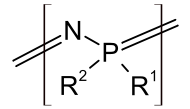 Monomeer van een polyfosfazeenpolymeer.
Monomeer van een polyfosfazeenpolymeer.
Dit anorganische polymeer is een rubberachtige substantie, die daarom anorganisch rubber wordt genoemd. Door de reactie nauwkeurig te controleren en op tijd te stoppen, bekomt men een lineair polymeer, dat oplosbaar is in onder andere benzeen, tolueen of tetrahydrofuraan. In een vochtige atmosfeer hydrolyseert dit tot ammoniumfosfaat en waterstofchloride, waardoor dit polymeer op zich niet praktisch bruikbaar is.
In een gepast oplosmiddel is dit lineaire poly(dichloorfosfazeen) wel een geschikt reagens. Door het te behandelen met organische nucleofielen zoals de natriumzouten van alcoholen (alkoxiden zoals natriumethoxide) of fenolen, of met primaire of secundaire amines, kan men alle chlooratomen in de polymeerketen vervangen door organische substituenten. De resulterende polymeren zijn - in tegenstelling tot anorganisch rubber - wel bestand tegen hydrolyse en hebben vaak interessante en bruikbare eigenschappen, die sterk uiteenlopen naargelang welke groep(en) in de polymeerketen ingebracht zijn. Er zijn honderden verschillende polyfosfazenen, die toepassing vinden in zeer uiteenlopende gebieden.
Toxicologie en veiligheid
Hexachloorfosfazeen is een corrosieve stof, en veroorzaakt ernstige irritatie en mogelijk brandwonden als het in contact komt met de huid of de ogen. Ook kan het de ademhalingswegen en de spijsverteringsorganen beschadigen bij inademing of ingestie. De toxicologische eigenschappen van het product zijn niet volledig onderzocht.
Het reageert bij contact met vocht of sterk oxiderende stoffen. Daarbij komen irriterende en giftige dampen vrij (waterstofchloride, stikstofoxiden en fosfine).
In de Europese Unie is hexachloorfosfazeen niet ingedeeld als een gevaarlijke stof (dat wil zeggen de stof is niet opgenomen in bijlage 1 bij de Europese Richtlijn 67/548/EEG betreffende de indeling, kenmerken en verpakking van gevaarlijke stoffen).
Literatuur
- J.E. Mark, H.R. Allcock & R. West (2005) - Inorganic Polymers (2nd Ed.), Oxford University Press - ISBN 978-0-19-513119-2
