Chlooraceetaldehyde
Chlooraceetaldehyde is een organische verbinding met als brutoformule C2H3ClO. De stof komt voor als een kleurloze heldere vloeistof met een scherpe geur, die mengbaar is met water.
Chlooraceetaldehyde
| ||||
| Structuurformule en molecuulmodel | ||||
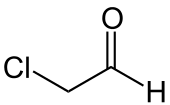 | ||||
Structuurformule van chlooraceetaldehyde | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C2H3ClO | |||
| IUPAC-naam | 2-chloorethanal | |||
| Andere namen | 2-chlooraceetaldehyde | |||
| Molmassa | 78,49762 g/mol | |||
| SMILES | C(C=O)Cl | |||
| InChI | 1S/C2H3ClO/c3-1-2-4/h2H,1H2 | |||
| CAS-nummer | 107-20-0 | |||
| EG-nummer | 203-472-8 | |||
| PubChem | 33 | |||
| Beschrijving | Kleurloze vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Opslag | Gescheiden van sterk oxiderende stoffen, zuren, metalen, voeding en voedingsmiddelen. | |||
| VN-nummer | 2232 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| MAC-waarde | 1 ppm | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Smeltpunt | 16 °C | |||
| Kookpunt | 85 – 85,5 °C | |||
| Vlampunt | (gesloten vat) 88 °C | |||
| Dampdruk | (bij 20°C) 13.300 Pa | |||
| Matig oplosbaar in | water | |||
| log(Pow) | 0,37 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Chlooraceetaldehyde wordt bereid door middel van een oxidatie van een waterige vinylchloride-oplossing met chloorgas:
Het kan ook bereid worden uit vinylacetaat.[1]
Eigenschappen en toepassingen
Chlooraceetaldehyde is een sterk elektrofiele molecule en wordt daarom als alkylerings-reagens gebruikt. In technische vorm wordt het vooral aangeboden als een 40%-oplossing (als acetaal), gezien het zeer corrosieve karakter van de watervrije verbinding. Chlooraceetaldehyde wordt verder gebruikt in de synthese van geneesmiddelen en verschillende heterocyclische verbindingen.
Toxicologie en veiligheid
De stof ontleedt bij verhitting met vorming van giftige chloordampen. Chlooraceetaldehyde reageert met oxidatoren, metalen en zuren, waardoor kans op ontploffing ontstaat.
De damp en de vloeistof zijn corrosief voor de ogen, de huid en de luchtwegen. Inademing van hoge concentraties van de damp kan longoedeem veroorzaken.
Zie ook
Externe links

- (en) MSDS van chlooraceetaldehyde
Bronnen, noten en/of referenties
|