Cadmiumoxide
Cadmiumoxide (CdO) is een anorganische verbinding van cadmium met zuurstof.
Cadmiumoxide
| ||||
| Structuurformule en molecuulmodel | ||||
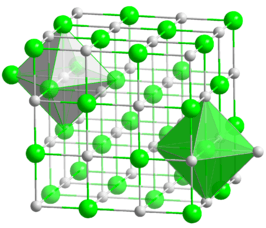 | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | CdO | |||
| IUPAC-naam | cadmiumoxide | |||
| Molmassa | 128,4 g/mol | |||
| CAS-nummer | 1306-19-0 | |||
| EG-nummer | 215-146-2 | |||
| Beschrijving | Bruine kristallen of kleurloos amorf poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H330 - H341 - H350 - H361 - H372 - H410 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P201 - P260 - P273 - P281 - P284 - P310 | |||
| Carcinogeen | mogelijk (IARC-klasse 2) | |||
| VN-nummer | 2570 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos-bruin | |||
| Dichtheid | 8,15 g/cm³ | |||
| Onoplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | kubisch | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
De commerciële productie van cadmiumoxide vindt plaats middels de reactie van cadmiumdamp (afkomstig van gesmolten metallisch cadmium), bij hoge temperatuur, met zuurstof. Het gevormde cadmiumoxide wordt afgescheiden in doekenfilters. De verhouding lucht-cadmiumdamp bepaalt de deeltjesgrootte van het product. De enige producent van cadmiumoxide in de Europese Unie is La Floridienne in Aat.[1]
Cadmiumoxide kan ook bekomen worden door de thermische ontleding van cadmiumcarbonaat of cadmiumhydroxide:
De oxidatie van cadmiumsulfide op hoge temperatuur levert eveneens cadmiumoxide:
De pyrolyse van cadmiumzouten van carbonzuren, bijvoorbeeld cadmiumoxalaat, levert fijn verdeeld cadmiumoxide:
Eigenschappen
Cadmiumoxide komt voor als amorf poeder (de α-vorm) en in kristalvorm (de β-vorm). De kristalstructuur is kubisch, zoals bij natriumchloride. Elk cadmiumatoom is daarbij omringd door zes zuurstofatomen, die de hoekpunten van een octaëder vormen. Zuivere kristallen zijn roodbruin van kleur, maar de kleur kan variëren tot zwartbruin als gevolg van onvolkomenheden in de kristalstructuur. Het is onoplosbaar in water en alkalische oplossingen, wel oplosbaar in minerale zuren.
De relatieve dichtheid ten opzichte van water van cadmiumoxide in kristalvorm is 8,15; amorf is dat 6,95. Amorf cadmiumoxide ontleedt tussen 900 en 1000 °C. De kristallijne vorm sublimeert bij 1559 °C.
Toepassingen
Cadmiumoxide wordt gebruikt in de fabricage van bepaalde types elektroden van nikkel-cadmium-accu's; van stabilisatoren om de hittebestendigheid te verbeteren van plastics en nitrilrubbers; van pigmenten. Het wordt ook toegevoegd aan baden voor elektroplating. Een kleine hoeveelheid wordt gebruikt als katalysator in organische reacties.
Cadmiumoxide wordt in reactie met azijnzuur gebruikt voor het bereiden van cadmiumacetaat.
Toxicologie en veiligheid
Cadmiumoxide is een zeer giftige stof, vooral bij inhalatie. Ze is irriterend voor de ogen en de luchtwegen. Inademing van de aerosol kan longoedeem veroorzaken. Blootstelling aan een hoge concentratie kan dodelijk zijn. Bij herhaalde of langdurige blootstelling kunnen de longen en de nieren aangetast worden.
Cadmiumoxide is waarschijnlijk kankerverwekkend bij de mens. Bij dierproeven is ook gebleken dat de stof mogelijk schadelijk is voor de voortplanting of de ontwikkeling.
Externe link
Bronnen, noten en/of referenties
|

