1,3,5-trinitrobenzeen
1,3,5-trinitrobenzeen, vaak afgekort tot TNB, is een genitreerd benzeen, dat bekendstaat als een sterk explosief. In vloeibare vorm explodeert de stof niet zo makkelijk; in gepoederde, droge vorm is het een extreem gevoelige verbinding. Trinitrobenzeen explodeert onder invloed van mechanische schokken. Een hoge temperatuur, of die het gevolg is van het plotseling verwarmen van een hoeveelheid trinitrobenzeen, of het gevolg van het opnemen van warmte tijdens een langere periode (brand), leidt ook tot explosies. Trinitrobenzeen reageert heftig met reducerende stoffen. Ook natriumdichromaat en zwavelzuur kunnen de explosie in gang zetten.[2]
1,3,5-trinitrobenzeen
| ||||||
| Structuurformule en molecuulmodel | ||||||
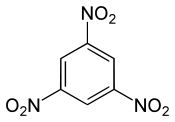 | ||||||
Structuurformule van 1,3,5-trinitrobenzeen | ||||||
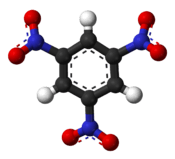 | ||||||
Molecuulmodel van 1,3,5-trinitrobenzeen | ||||||
| Algemeen | ||||||
| Molecuulformule (uitleg) | C6H3N3O6 | |||||
| IUPAC-naam | 1,3,5-trinitrobenzeen | |||||
| Andere namen | TNB, trinitrobenzeen, benzit, RC, RA | |||||
| Molmassa | 213,1045 g/mol | |||||
| SMILES | C1=C(C=C(C=C1[N+](=O)[O-])[N+](=O)[O-])[N+](=O)[O-] | |||||
| CAS-nummer | 99-35-4 | |||||
| EG-nummer | 202-752-7 | |||||
| PubChem | 7434 | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H201 - H300 - H310 - H330 - H373 - H410 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | P260 - P264 - P273 - P280 - P284 - P301+P310 | |||||
| VN-nummer | 0388 | |||||
| LD50 (ratten) | (oraal) 275 mg/kg | |||||
| LD50 (muizen) | (oraal) 572 mg/kg (intraveneus) 32 mg/kg | |||||
| Fysische eigenschappen | ||||||
| Dichtheid | 1,76 g/cm³ | |||||
| Smeltpunt | (polymorf I) 125,2[1] °C | |||||
| Kookpunt | 315 °C | |||||
| Oplosbaarheid in water | 0,330 g/l | |||||
| log(Pow) | 1,18 | |||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Synthese
De synthese van trinitrobenzeen verloopt via de nitrering van 1,3-dinitrobenzeen in een mengsel van rokend salpeterzuur en geconcentreerd zwavelzuur. Een andere route verloopt via 2,4,6-trinitrotolueen of TNT, dat eerst tot 2,4,6-trinitrobenzoëzuur geoxideerd wordt met kaliumdichromaat en zwavelzuur, waarna een decarboxylering in kokend water volgt.[3]
Fysische eigenschappen
Van trinitrobenzeen zijn vijf polymorfen bekend. De thermodynamisch stabiele vorm I smelt bij 125,3 °C met een smeltwarmte van 15,0 kJ·mol−1. De metastabiele vormen II en III hebben hun smeltpunt bij 107,2 °C en 109,8 °C (smeltwarmte 14,8 kJ·mol−1 resp. 13,2 kJ·mol−1). Beide vormen zijn monotroop ten opzichte van vorm I. De vormen II en III zijn ten opzichte van elkaar enantiotroop. Bij ongeveer 97 °C gaan de vormen II en III in elkaar over.[1] Twee andere vormen hebben smeltpunten bij 109 °C en 88 °C. De smeltwarmte van deze polymorfen is nog niet bekend.[4]
Toepassingen
Trinitrobenzeen wordt voornamelijk toegepast als explosief, zowel commercieel in de mijnbouw als militair. Hierin lijkt het veel op het veel bekendere TNT. Daarnaast zijn er beperkte toepassingen als pH-indicator, reagens om rubber te vulkaniseren en als intermediair in de synthese van andere explosieven. Trinitrobenzeen is de uitgangsstof voor floroglucinol dat als medicijn op de markt wordt gebracht.
Kenmerken van trinitrobenzeen als explosief
Trinitrobenzeen is een beter explosief dan TNT.[3] In dit verband belangrijke kentallen zijn:
Vormingswarmte −134,5 kJ·kg−1[3] Vormingsenthalpie −204,3 kJ·kg−1[3] Zuurstofbalans −56,3 %[3] Stikstofgehalte 19,72 %[3] gasvolume 939 l·kg−1[3] Explosiewarmte 3927 kJ·kg−1 (H2O (l))
3845 kJ·kg−1 (H2O (g))[3]Specifieke energie 1051 kJ·kg−1 (107,1 mt/kg)[3] Explosiesnelheid 7300 m·s−1 bij een dichtheid van 1,6 g·cm−3[3] Slaggevoeligheid 7,4 Nm[3] Drukgevoeligheid tot 353 N puntbelasting geen reactie
Toxicologie en veiligheid
Algemeen geldt voor organische nitroverbindingen dat ze ten gevolge van mechanische schok, blootstelling aan warmte of vlammen, of door een spontane chemische reactie kunnen exploderen. De opslag van trinitrobenzeen moet dus koel, goed geventileerd, en gescheiden van reducerende stoffen of bronnen van open vuur zijn. De lijst met reducerende stoffen waarvan bekend is dat ze gevaarlijke combinaties met trinitrobenzeen vormen omvat: aluminium, boorfosfide, cyaniden, esters, fosfor, natriumcyanide, natriumhypofosfiet en thiocyanaten. Bij verhitting totdat de stof ontleed ontstaan zeer giftige dampen zoals stikstofoxiden.[5]
De veiligheidsregels rond trinitrobenzeen zijn eenvoudig: voorkom contact met de stof zo veel mogelijk, voorkom inademen van stof, en dampen van brandend of reagerend materiaal. Bij omgang moet de stof moeten geschikte beschermende handschoenen en veiligheidsbril gedragen worden. Trinitrobenzeen mag niet opgeslagen worden in de nabijheid van andere chemicaliën, in het bijzonder andere oxidatoren, niet in de buurt van verwarmingsbronnen of plaatsen waar plotselinge temperatuursveranderingen kunnen optreden. Bij morsen moet de stof direct met veel water nat gemaakt worden en daarna voorzichtig en langzaam opgeruimd worden.
De meest voorkomende manieren waarop men in contact komt met trinitrobenzeen zijn direct hanteren van de verbinding of door het drinken van met trinitrobenzeen verontreinigd water. Van trinitrobenzeen wordt aangenomen dat het tot vergelijkbare gezondheidsproblemen leidt als TNT. Blootstelling aan hoge concentraties leidt doorgaans tot bloedarmoede, of een verlaagde capaciteit van het bloed om zuurstof te transporteren. Door het zuurstofgebrek zal de huid blauw of paars verkleuren. Andere symptomen zijn ander anderen hoofdpijn, misselijkheid en duizeligheid. Lange termijn effecten van de stof zijn niet bekend, omdat deze onderzoeken niet zijn uitgevoerd. Wel wordt aangenomen dat steriliteit (bij mannen) en cataracten tot de mogelijkheden behoren. Het is niet bekend of trinitrobenzeen tot aangeboren afwijkingen aanleiding geeft.[6]
Externe links
- (en) Gegevens van 1,3,5-trinitrobenzeen in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van 1,3,5-trinitrobenzeen
Bronnen, noten en/of referenties
|



