Kaliumdichromaat
Kaliumdichromaat is het kaliumzout van dichroomzuur en bezit als brutoformule K2Cr2O7. De stof komt voor als een helder-oranje kristallijne vaste stof, die matig goed oplosbaar is in water.
Kaliumdichromaat
| |||||||
| Structuurformule en molecuulmodel | |||||||
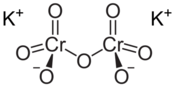 | |||||||
Structuurformule van kaliumdichromaat | |||||||
Kaliumdichromaat-kristallen | |||||||
| Algemeen | |||||||
| Molecuulformule (uitleg) | K2Cr2O7 | ||||||
| IUPAC-naam | kaliumdichromaat | ||||||
| Molmassa | 294,1846 g/mol | ||||||
| SMILES | [O-][Cr](=O)(=O)O[Cr](=O)(=O)[O-].[K+].[K+] | ||||||
| InChI | 1S/2Cr.2K.7O/q;;2*+1;;;;;;2*-1 | ||||||
| CAS-nummer | 7778-50-9 | ||||||
| EG-nummer | 231-906-6 | ||||||
| PubChem | 24502 | ||||||
| Beschrijving | Oranje kristallen | ||||||
| Vergelijkbaar met | natriumdichromaat, kaliumchromaat | ||||||
| Waarschuwingen en veiligheidsmaatregelen | |||||||
| |||||||
| H-zinnen | H272 - H301 - H312 - H314 - H317 - H330 - H334 - H340 - H350 - H360 - H372 - H410 | ||||||
| EUH-zinnen | geen | ||||||
| P-zinnen | P201 - P220 - P261 - P273 - P280 - P305+P351+P338 | ||||||
| Carcinogeen | ja (IARC-klasse 2) | ||||||
| EG-Index-nummer | 024-002-00-6 | ||||||
| VN-nummer | 3288 | ||||||
| Fysische eigenschappen | |||||||
| Aggregatietoestand | vast | ||||||
| Kleur | oranje | ||||||
| Dichtheid | 2,6760 g/cm³ | ||||||
| Smeltpunt | 398 °C | ||||||
| Oplosbaarheid in water | (bij 20°C) 123 g/l | ||||||
| Goed oplosbaar in | water | ||||||
| Onoplosbaar in | ethanol | ||||||
| Thermodynamische eigenschappen | |||||||
| ΔfH | −2033 kJ/mol | ||||||
| S | 291,2 J/mol·K | ||||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||||
| |||||||
Kaliumdichromaat komt in de natuur voor als het mineraal lopeziet.
Synthese
Op industriële schaal wordt kaliumdichromaat bereid door het smelten van het mineraal chromiet, kaliumcarbonaat en calciumcarbonaat, waarbij oxidatie bewerkstelligd wordt door het doorblazen van lucht. Aanvankelijk ontstaat hierbij het gele kaliumchromaat, maar dat wordt eerst uitgeloogd en vervolgens behandeld met een zuur en omgekristalliseerd.
Op kleinere schaal (in het laboratorium) wordt het bereid door reactie van chroom(III)oxide met kaliumnitraat:
Eigenschappen en toepassingen
Chroom bezit in deze verbinding oxidatiegetal +VI en bijgevolg is de verbinding een sterke oxidator (voornamelijk in zuur milieu). In de analytische chemie wordt de verbinding gebruikt als oertiterstof voor natriumthiosulfaat en als oxiderend reagens tijdens de CZV-bepaling. Kaliumdichromaat staat in evenwicht met kaliumchromaat via een pH-afhankelijke evenwichtsreactie:
De kleur van de oplossing verandert daardoor van oranje (in zuur milieu) naar geel (in basisch milieu). Spectroscopische bepalingen aan kaliumdichromaat worden om die reden altijd in sterk zuur milieu uitgevoerd. Omwille van de intense kleur van dichromaat en chromaat werden de kaliumzouten hiervan gebruikt als pigmenten voor het maken van verven.[1]
Toxicologie en veiligheid
Kaliumdichromaat bevat hexavalent chroom: deze verbindingen zijn bewezen kankerverwekkend bij inademing. Daarnaast is de verbinding zeer toxisch en corrosief voor de huid en de ogen. Bij inademing van de stof treedt irritatie van de luchtwegen op. Intense of langdurige blootstelling aan de stof kan leiden tot de dood.
Externe link
Bronnen, noten en/of referenties
|




