Zilverperchloraat
Zilverperchloraat is een anorganische verbinding van zilver met als brutoformule AgClO4. Deze witte, vaste stof vormt een monohydraat en is licht hygroscopisch. Als bron van zilver-ionen (Ag+) is de stof goed bruikbaar, hoewel de aanwezigheid van het perchloraationen een zeker risico met zich meebrengt wegens de sterk oxiderende werking ervan. Als alternatief wordt vrijwel steeds zilvernitraat of zilver(I)fluoride aangewend.
Zilverperchloraat
| ||||
| Structuurformule en molecuulmodel | ||||
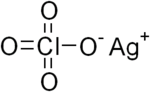 | ||||
Structuurformule van zilverperchloraat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | AgClO4 | |||
| IUPAC-naam | zilverperchloraat | |||
| Molmassa | 207,3188 g/mol | |||
| SMILES | [O-]Cl(=O)(=O)=O.[Ag+] | |||
| InChI | 1/Ag.ClHO4/c;2-1(3,4)5/h;(H,2,3,4,5)/q+1;/p-1/fAg.ClO4/qm;-1 | |||
| CAS-nummer | 14242-05-8 | |||
| EG-nummer | 232-035-4 | |||
| PubChem | 24562 | |||
| Vergelijkbaar met | zilvernitraat | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H272 - H314[1] | |||
| EUH-zinnen | geen[1] | |||
| P-zinnen | P220 - P280 - P305+P351+P338 - P310[1] | |||
| VN-nummer | 1481 | |||
| ADR-klasse | Gevarenklasse 5.1 | |||
| Fysische eigenschappen | ||||
| Smeltpunt | (ontleedt) 486[2] °C | |||
| Oplosbaarheid in water | 5570 g/l | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | kubisch | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Oplosbaarheid
Zilverperchloraat is bekend om zijn oplosbaarheid in aromatische oplosmiddelen, zoals benzeen (52,8 g/L) en tolueen (1010 g/L).[3] In deze oplosmiddelen bindt het zilverion aan de aromaat, zoals uit kristallografisch onderzoek blijkt.[4][5]
Verwante verbindingen
Vergelijkbaar met zilvernitraat, is zilverperchloraat een effectief reagens om halide-ionen te vervangen door (in dit geval dan) perchloraat dat een zwak tot niet coördinerend anion is. Het belang van zilverperchloraat in de synthese van nieuwe verbindingen is de laatste tijd minder in verband met het explosieve karakter van de zouten. De rol in de synthese is overgenomen door bijvoorbeeld zilvertetrafluorboraat, zilvertrifluormethaansulfonaat en zilverhexafluorfosfaat.
Bronnen, noten en/of referenties
|

