Sulfaminezuur
Sulfaminezuur is een matig sterk anorganisch zuur met als brutoformule H3NSO3. De stof komt voor als een witte tot kleurloze, reukloze, kristallijne vaste stof die oplosbaar is in water. Daarin hydrolyseert het langzaam tot ammoniumwaterstofsulfaat.
Sulfaminezuur
| ||||
| Structuurformule en molecuulmodel | ||||
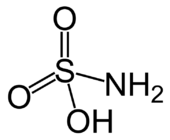 | ||||
Structuurformule van sulfaminezuur | ||||
 | ||||
Sulfaminezuur-kristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | H3NSO3 | |||
| Andere namen | amidosulfonzuur | |||
| Molmassa | 97,09372 g/mol | |||
| SMILES | NS(=O)(=O)O | |||
| InChI | 1S/H3NO3S/c1-5(2,3)4/h(H3,1,2,3,4) | |||
| CAS-nummer | 5329-14-6 | |||
| EG-nummer | 226-218-8 | |||
| PubChem | 5987 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H412 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P305+P351+P338 | |||
| EG-Index-nummer | 016-026-00-0 | |||
| VN-nummer | 2967 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| LD50 (ratten) | (oraal) 3160 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos-wit | |||
| Dichtheid | 2,1 g/cm³ | |||
| Smeltpunt | 205 °C | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Structuur en eigenschappen
Sulfaminezuur kan - afhankelijk van de pH - voorkomen als een zwitterion:
 Zwitterion van sulfaminezuur
Zwitterion van sulfaminezuur
De pKa van sulfaminezuur bedraagt 1,0.
Toepassingen
Sulfaminezuur is een ingrediënt van vele zure reinigingsmiddelen voor het verwijderen van aanslagen: kalkaanslag in koffiezetapparaten en op chroom of roestvrij staal onder meer in melkerijen en brouwerijen, in stoomketels, cementsluier op tegels en urinesteen op sanitair. Sulfaminezuur wordt ook gebruikt voor de synthese van kunstmatige zoetstoffen (cyclaamzuur en natriumcyclamaat).
De zouten van sulfaminezuur worden sulfamaten genoemd. Het ammoniakzout ammoniumsulfamaat wordt bijvoorbeeld gebruikt als herbicide.
Toxicologie en veiligheid
Sulfaminezuur is corrosief voor de huid, ogen en luchtwegen. Naargelang de mate van blootstelling geeft dit aanleiding tot roodheid, een branderig gevoel of zelfs ernstige brandwonden. Inademing van een aerosol kan longoedeem veroorzaken; dit kan vertraagd optreden tot 48 uur na blootstelling.
Externe links

- (en) Gegevens van Sulfaminezuur in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van sulfaminezuur
