Palladium(II)chloride
Palladium(II)chloride is het palladiumzout van waterstofchloride en heeft als brutoformule PdCl2. De stof komt voor als een hygroscopische donkerrode vaste stof, die matig oplosbaar is in koud water.
Palladium(II)chloride
| ||||
| Structuurformule en molecuulmodel | ||||
 | ||||
Palladium(II)chloride | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | PdCl2 | |||
| IUPAC-naam | palladium(II)chloride | |||
| Andere namen | palladiumdichloride | |||
| Molmassa | 177,326 g/mol | |||
| SMILES | Cl[Pd]Cl | |||
| InChI | 1S/2ClH.Pd/h2*1H;/q;;+2/p-2 | |||
| CAS-nummer | 7647-10-1 | |||
| EG-nummer | 231-596-2 | |||
| PubChem | 24290 | |||
| Beschrijving | Donkerrode vaste stof | |||
| Vergelijkbaar met | platina(II)chloride | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H317[1] | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P301+P310[1] | |||
| Hygroscopisch? | ja | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | donkerrood | |||
| Dichtheid | 4,0 g/cm³ | |||
| Smeltpunt | 679 °C | |||
| Goed oplosbaar in | zoutzuur, organische oplosmiddelen | |||
| Matig oplosbaar in | koud water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | trigonaal | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Palladium(II)chloride kan bereid worden door metallisch palladium op te lossen in koningswater of sterk geconcentreerd zoutzuur, in een chloorgas-atmosfeer.
Structuur en eigenschappen
Palladium(II)chloride is qua kristalstructuur vergelijkbaar met platina(II)chloride. Er zijn 2 kristalstructuren van palladium(II)chloride bekend: een α- en een β-vorm. In beide vormen nemen de palladiumatomen een vierkant-planaire structuur aan, die karakteristiek is voor palladium(II)-zouten. Verder worden de palladiumatomen verbonden door middel van 2 chloorbruggen. In de α-vorm neemt het zout een polymeerstructuur aan, bestaande uit zeer lange ketenstructuren. De β-vorm, die moleculair van aard is, neemt een octaëdrische clustervorm aan met zes palladiumatomen en twaalf chlooratomen (die de brug tussen twee palladiumatomen vormen).
-chloride-xtal-3D-balls.png) | 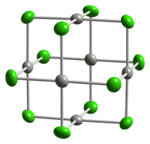 |
van α-palladium(II)chloride | van β-palladium(II)chloride |
Eigenschappen en toepassingen
Vanaf 600°C ontleedt palladium(II)chloride in palladium en dichloor. Het lost zeer gemakkelijk op in zoutzuur, doordat het 2 chloride-ionen opneemt en daarmee het tetrachloropalladaat-ion vormt:
Palladium(II)chloride wordt als uitgangsstof gebruikt in de palladiumchemie, alsook in talrijke organische reacties. Zo katalyseert het de oxidatie van etheen tot aceetaldehyde.
Bij het oplossen in waterstofsulfide ontstaat een bruin-zwarte neerslag van palladium(II)sulfide. Palladium(IV)sulfide kan gevormd worden door het verhitten van palladium(II)chloride met zwavel.
Een belangrijke toepassingen van deze stof is de detectie van koolstofmonoxide. Hiervoor wordt filtreerpapier in een zeer sterk verdunde oplossing van palladium(II)chloride gedrenkt. Wanneer dit papier nu in contact komt met koolstofmonoxide (of andere reductantia), wordt zwart palladium gevormd door reductie ervan:
Palladium(II)chloride wordt gebruikt in de synthese van de palladiumkatalysator tetrakis(trifenylfosfine)palladium(0). Hiervoor wordt eerst het dichloorbis(trifenylfosfine)palladium(II)-complex gevormd door reactie van palladium(II)chloride met trifenylfosfine in benzonitril. Vervolgens worden hydrazine en trifenylfosfine in reactie hiermee gebracht en na afkoeling van het reactiemengsel slaat het palladiumcomplex neer en kan het afgefilterd worden.[2]
Bronnen, noten en/of referenties
|
