Natriumhypochloriet
Natriumhypochloriet is het natriumzout van waterstofhypochloriet, met als brutoformule NaClO. De zuivere stof is een groen-gele vaste stof met een onaangename geur, maar meestal wordt het als oplossing in water gebruikt (bleekloog).
Natriumhypochloriet
| ||||
| Structuurformule en molecuulmodel | ||||
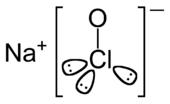 | ||||
Structuurformule van natriumhypochloriet | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | NaOCl | |||
| IUPAC-naam | natriumhypochloriet | |||
| Andere namen | bleekloog | |||
| Molmassa | 74,44217 g/mol | |||
| SMILES | NaClO | |||
| InChI | 1/NaClO/c1-2;/q-1;+1 | |||
| CAS-nummer | 7681-52-9 | |||
| EG-nummer | 231-668-3 | |||
| PubChem | 23665760 | |||
| Beschrijving | Groen-gele vaste stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 - H400 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P280 - P305+P351+P338 - P310 | |||
| EG-Index-nummer | 017-011-00-1 | |||
| VN-nummer | 1791 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | groen-geel | |||
| Dichtheid | 1,2 g/cm³ | |||
| Smeltpunt | (pentahydraat) 18 °C | |||
| Oplosbaarheid in water | 293 g/l | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Natriumhypochloriet wordt bereid als pentahydraat door chloorgas door een oplossing van natriumhydroxide te leiden:[1]
Een alternatieve methode is de elektrolyse van natriumchloride in water. Aan de anode wordt chloorgas gevormd door oxidatie van chloride-ionen:
Aan de kathode wordt water gereduceerd:
Wanneer het gevormde chloorgas in contact komt met de hydroxide-ionen, wordt hypochloriet gevormd:
Watervrij natriumhypochloriet is zeer explosief. Het kan bereid worden door vriesdrogen van het pentahydraat met geconcentreerd zwavelzuur.[2]
Eigenschappen en reacties
Natriumhypochloriet is een sterke oxidator, die onedele metalen (zoals zink) kan omzetten in hun oxiden:
De stof reageert met waterstofchloride, waardoor het toxische chloorgas gevormd wordt:
Natriumhypochloriet is vrij onstabiel en ontleedt door verhitting tot natriumchloraat en natriumchloride:
De reactie met waterstofperoxide stelt zuurstofgas vrij:
Toepassingen
Natriumhypochloriet wordt in het organisch laboratorium gebruikt voor oxidaties, zoals de oxidatie van alcoholen tot ketonen. In zwembaden wordt natriumhypochloriet gebruikt om het zwemwater te chloreren. Als alternatief wordt ook wel het stabielere trichloorisocyanuurzuur gebruikt.
Daarnaast is natriumhypochloriet in de vorm van een 5% oplossing in water (bleekwater) ook een veelgebruikt ontsmettingsmiddel voor sanitair.
In de tandheelkunde wordt een 2% oplossing gebruikt om reiniging en desinfectie te verkrijgen van het wortelkanaal tijdens endodontologische behandelingen (wortelkanaalbehandeling).
Verder wordt het in grondwater toegevoegd om het te zuiveren tot drinkwater.
Natriumhypochloriet kan giftige cyaniden oxideren tot de overeenkomstige cyanaten. Zodoende kan het gebruikt worden om oplossingen van cyaniden onschadelijk te maken:
Externe links

- (en) Gegevens van Natriumhypochloriet in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- (en) MSDS van natriumhypochloriet
Bronnen, noten en/of referenties
|

