Kaliumsulfaat
Kaliumsulfaat is een anorganische verbinding met als brutoformule K2SO4.
Kaliumsulfaat
| ||||
| Structuurformule en molecuulmodel | ||||
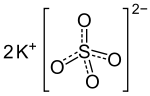 | ||||
Structuurformule van kaliumsulfaat | ||||
Kaliumsulfaat in poedervorm | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | K2SO4 | |||
| IUPAC-naam | kaliumsulfaat | |||
| Andere namen | tartarus vitriolatus | |||
| Molmassa | 174,26 g/mol | |||
| CAS-nummer | 7778-80-5 | |||
| EG-nummer | 231-915-5 | |||
| PubChem | 24507 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 2,660 g/cm³ | |||
| Smeltpunt | 1067 °C | |||
| Kookpunt | 1689 °C | |||
| Oplosbaarheid in water | (bij 20°C) 120 g/L (bij 100°C) 250 g/l | |||
| Goed oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | orthorombisch | |||
| Nutritionele eigenschappen | ||||
| Type additief | zoutvervanger | |||
| E-nummer | E515 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Geschiedenis
De apotheker Johann Rudolph Glauber vervaardigde als eerste in de 17e eeuw kaliumsulfaat uit kaliumchloride en zwavelzuur.
Voorkomen
Kaliumsulfaat komt voor als dubbelzout in de volgende mineralen:
- Kaïniet: MgSO4 · KCl · 3 H2O
- Schöniet: K2SO4 · MgSO4 · 6 H2O
- Leoniet: K2SO4 · MgSO4 · 4 H2O
- Langbeiniet: K2SO4 · 2 MgSO4
- Glaseriet: K3Na(SO4)2
- Polyhaliet: K2SO4 · MgSO4 · 2 CaSO4 · 2 H2O
Productie
In het begin werd kaliumsulfaat gewonnen uit het mineraal kaïniet, maar al snel werd op een goedkopere methode overgegaan, waarbij uitgegaan wordt van kaliumchloride. Een mogelijke vervaardiging van kaliumsulfaat uit kaliumchloride en zwavelzuur bij 700 °C is:
Bij de volgende methode wordt gebruikgemaakt van andere metaalsulfaten zoals magnesiumsulfaat:
Bij het Hargreaves-proces wordt kaliumchloride met een mengsel van zwaveldioxide, licht en water omgzet in kaliumsulfaat:
Kaliumsulfaat wordt ook als bijproduct verkregen bij de productie van salpeterzuur.
Het makkelijkst is kaliumsulfaat te produceren uit kaliumhydroxide en zwavelzuur.
Eigenschappen
De watervrije kristallen zijn orthorombisch van structuur. Ze zijn kleurloos en doorzichtig, zeer hard en aan de lucht uiterst stabiel. Kaliumsulfaat smaakt bitter en naar kookzout. Ze zijn goed oplosbaar in water, maar onoplosbaar in ethanol.
Toepassingen
Het wordt hoofdzakelijk als kunstmest gebruikt in de vorm van chloorarme kali of patentkali. Bij chloorminnende gewassen zoals de druif wordt kaliumchloride gebruikt. Daarnaast wordt het in samengestelde meststoffen gebruikt.
Verder wordt kaliumsulfaat gebruikt bij het produceren van aluinen, kaliwaterglas, kaliumpersulfaat, potas en synthetische gum. Verder wordt het gebruikt bij het verwijderen van wijnsteen en wijnsteenzuur, in verfstoffen, springstoffen en farmaceutische industrie.
In dieetlevensmiddelen wordt kaliumsulfaat gebruikt ter vervanging van het keukenzout (NaCl).