Benzeensulfonylchloride
Benzeensulfonylchloride is een organische verbinding met als brutoformule C6H5SO2Cl. De stof komt voor als een kleurloze viskeuze vloeistof met een prikkelende geur. De stof hydrolyseert in water tot benzeensulfonzuur en waterstofchloride.
Benzeensulfonylchloride
| |||||
| Structuurformule en molecuulmodel | |||||
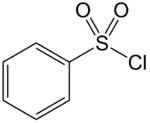 | |||||
Structuurformule van benzeensulfonylchloride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C6H5SO2Cl | ||||
| IUPAC-naam | benzeensulfonylchloride | ||||
| Andere namen | benzeensulfonzuurchloride | ||||
| Molmassa | 176,62 g/mol | ||||
| SMILES | C1=CC=C(C=C1)S(=O)(=O)Cl | ||||
| InChI | 1S/C6H5ClO2S/c7-10(8,9)6-4-2-1-3-5-6/h1-5H | ||||
| CAS-nummer | 98-09-9 | ||||
| EG-nummer | 202-636-6 | ||||
| PubChem | 7369 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H314 - H317 - H332 - H334 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P261 - P280 - P305+P351+P338 - P310 | ||||
| VN-nummer | 2225 | ||||
| LD50 (ratten) | (oraal) 1960 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 1,384 g/cm³ | ||||
| Smeltpunt | 14-15 °C | ||||
| Kookpunt | (ontleedt) 251 °C | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Benzeensulfonylchloride is het sulfonzuurchloride van benzeensulfonzuur.
Synthese
Benzeensulfonylchloride wordt bereid door de reactie van benzeen met chloorsulfonzuur.[1]
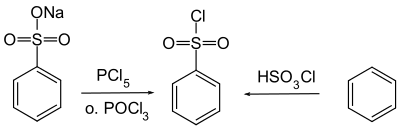 Synthese van benzeensulfonylchloride
Synthese van benzeensulfonylchloride
Een alternatieve methode is de behandeling van natriumbenzeensulfonaat (ontstaan door de reactie van benzeensulfonzuur met natriumhydroxide in oplossing) met fosforpentachloride of fosforylchloride.[2]
Toepassingen en reacties
Benzeensulfonylchloride wordt vooral gebruikt als bouwsteen voor de synthese van andere verbindingen, waaronder sulfonamiden (bijvoorbeeld N-butylbenzeensulfonamide). Deze stoffen bezitten vaak een welbepaalde farmaceutische activiteit.
Het kan gereduceerd worden tot thiofenol, met behulp van zink in zwavelzuur.[3]
Hinsbergtest
Benzeensulfonylchloride wordt in de Hinsbergtest of Hinsbergreactie gebruikt om primaire, secundaire en tertiaire amines te onderscheiden. Met primaire of secundaire amines reageert de stof tot een sulfonamide, waarbij waterstofchloride vrijgesteld wordt. Met tertiaire amines gebeurt dit niet. De test wordt uitgevoerd in een waterige base (natriumhydroxide of kaliumhydroxide), en het vrijkomende waterstofchloride wordt geneutraliseerd door de base. Het sulfonamide dat met een secundair amine ontstaat is meestal een onoplosbare vaste stof die onmiddellijk neerslaat. Het sulfonamide van een primaire amine vormt een oplosbaar zout. Na aanzuring van de oplossing slaat het neer.[4] Deze reactie werd in 1890 ontdekt door de Duitse scheikundige Oscar Hinsberg.
Externe links
- (en) MSDS van benzeensulfonylchloride
- (en) Gegevens van Benzeensulfonylchloride in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|


