Benzeensulfonzuur
Benzeensulfonzuur is een organische verbinding en behoort tot de sulfonzuren. De stof komt voor als kleurloze kristallen. De zouten en esters worden besylaten genoemd.
Benzeensulfonzuur
| ||||
| Structuurformule en molecuulmodel | ||||
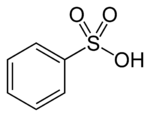 | ||||
Structuurformule van benzeensulfonzuur | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C6H6O3S | |||
| IUPAC-naam | benzeensulfonzuur | |||
| Molmassa | 158,17504 g/mol | |||
| SMILES | C1=CC=C(C=C1)S(=O)(=O)O | |||
| InChI | 1S/C6H6O3S/c7-10(8,9)6-4-2-1-3-5-6/h1-5H,(H,7,8,9) | |||
| CAS-nummer | 98-11-3 | |||
| EG-nummer | 202-638-7 | |||
| PubChem | 7371 | |||
| Beschrijving | Kleurloze kristallen[1] | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H315 - H318 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P301+P310 - P305+P351+P338 | |||
| LD50 (ratten) | 0,89[2] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos-wit | |||
| Dichtheid | (bij 47°C) 1,32[3] g/cm³ | |||
| Smeltpunt | (watervrij) 51[1]°C (hydraat) 44[1] °C | |||
| Kookpunt | 190[3] °C | |||
| Goed oplosbaar in | alcoholen[1] | |||
| Onoplosbaar in | apolaire oplosmiddelen[1] | |||
| Evenwichtsconstante(n) | pKa = 0,7[1] | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Benzeensulfonzuur kan door directe aromatische sulfonering van benzeen bereid worden:
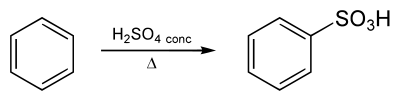 Synthese van benzeensulfonzuur uit benzeen en geconcentreerd zwavelzuur.
Synthese van benzeensulfonzuur uit benzeen en geconcentreerd zwavelzuur.
Tyrer-sulfonering
Bij de Tyrer-sulfonering,[4] vroeger van technisch belang, wordt benzeen door 90% zwavelzuur geleid. De temperatuur wordt verhoogd van 100 tot 180°C, waarbij water en benzeen in een condensor kunnen worden opgevangen. De benzeen wordt steeds teruggevoerd naar het reactievat. Uiteindelijk wordt een opbrengst van 80% gehaald.
Eigenschappen
De damp van benzeensulfonzuur is 5,5 keer zwaarder dan lucht.[5]
Toepassingen
Benzeensulfonzuur is een uitgangsstof in de bereiding van wasmiddelen, vooral in de vorm van zouten en esters. (zoals alkylderivaten of natriumzout). Verder wordt de stof toegepast als katalysator en als tussenproduct in de bereiding van resorcinol (via benzeen-1,3-disulfonzuur) en fenol. Beide reacties verlopen via het verhitten van de zuren met vast natriumhydroxide.
Bronnen, noten en/of referenties
|

