Ammoniumcarbonaat
Ammoniumcarbonaat, ook wel vlugzout genoemd, is een anorganische verbinding, die aan de lucht of bij verwarming gemakkelijk ontleedt. Bij die ontleding komt naast water en koolstofdioxide het irriterende ammoniak vrij.
Ammoniumcarbonaat
| ||||
| Structuurformule en molecuulmodel | ||||
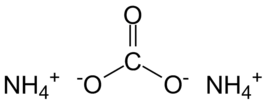 | ||||
Structuurformule van ammoniumcarbonaat | ||||
Ammoniumcarbonaat-kristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | (NH4)2CO3 | |||
| IUPAC-naam | ammoniumcarbonaat | |||
| Andere namen | vlugzout, hertshoornzout, reukzout | |||
| Molmassa | 96,09 g/mol | |||
| SMILES | C(=O)([O-])[O-].[NH4+].[NH4+] | |||
| CAS-nummer | 10361-29-2 | |||
| EG-nummer | 233-786-0 | |||
| Beschrijving | Wit kristallijn poeder | |||
| Vergelijkbaar met | natriumcarbonaat | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 | |||
| EUH-zinnen | geen | |||
| P-zinnen | geen | |||
| Opslag | Stevig gesloten houden | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 0,80 g/cm³ | |||
| Smeltpunt | 58 °C | |||
| Kookpunt | (ontleedt) 58 °C | |||
| Dampdruk | 6900 Pa | |||
| Oplosbaarheid in water | 320 g/l | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Met vlugzout wordt soms ook ammoniumwaterstofcarbonaat (ammoniumbicarbonaat) bedoeld.
Synthese
Ammoniumcarbonaat kan bereid worden door koolstofdioxide met ammoniak te laten reageren:
Een andere syntheseroute is het verhitten van calciumcarbonaat met ammoniumsulfaat:
Nadeel van deze methode is dat er ook ammoniumwaterstofcarbonaat en ammoniumcarbamaat ontstaan.
Toepassingen
Ammoniumcarbonaat wordt gebruikt bij de synthese van heterocyclische verbindingen en in sommige fotografische ontwikkelbaden. Verder wordt het wel gebruikt als rijsmiddel in bijvoorbeeld cake. Het E-nummer is E503i.
Een traditionele toepassing van ammoniumcarbonaat is het bijbrengen van iemand die flauwvalt. Deze werking is gebaseerd op het vrijkomen van ammoniakgas: de irriterende geur is een sterke prikkel voor de bewusteloze persoon.
In de klassieke kwalitatieve analyse wordt ammoniumcarbonaat gebruikt als reagens op ionen van barium, calcium en strontium. Daarbij slaan de overeenkomstige carbonaten neer.
