Styreen
Styreen is de triviale en meest gebruikte naam van ethenylbenzeen, een organische verbinding met als brutoformule C8H8. Bij kamertemperatuur komt het voor als een kleurloze vloeistof met een onaangename geur. Styreen wordt voornamelijk gebruikt als monomeer voor de productie van polymeren. Omdat styreen onder invloed van licht of zuurstof spontaan kan polymeriseren, wordt een kleine hoeveelheid 4-tert-butylcatechol toegevoegd als stabilisator.
Styreen
| |||||
| Structuurformule en molecuulmodel | |||||
 | |||||
Structuurformule van styreen | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C8H8 | ||||
| IUPAC-naam | ethenylbenzeen | ||||
| Andere namen | cinnameen, cinnamol, diarex HF 77, fenethyleen, fenyletheen, styrol, styropol, vinylbenzeen | ||||
| Molmassa | 104,14912 g/mol | ||||
| SMILES | C=CC1=CC=CC=C1 | ||||
| InChI | 1S/C8H8/c1-2-8-6-4-3-5-7-8/h2-7H,1H2 | ||||
| CAS-nummer | 100-42-5 | ||||
| EG-nummer | 202-851-5 | ||||
| PubChem | 7501 | ||||
| Vergelijkbaar met | ethylbenzeen, polystyreen, stilbeen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H226 - H315 - H319 - H332 - H361d | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P305+P351+P338 | ||||
| Omgang | damp niet inademen, contact vermijden | ||||
| Opslag | stevig gesloten houden (wegens lichtgevoeligheid) verwijderd van hitte vonken en bronnen van open vlammen; bewaren bij 2-8°C | ||||
| EG-Index-nummer | 601-026-00-0 | ||||
| VN-nummer | 2055 | ||||
| ADR-klasse | Gevarenklasse 3 | ||||
| LD50 (ratten) | (oraal) 2650 mg/kg (intraperitoneaal) 898 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,91[1] g/cm³ | ||||
| Smeltpunt | −30,6[1] °C | ||||
| Kookpunt | 145[1] °C | ||||
| Vlampunt | 32[1] °C | ||||
| Zelfontbrandings- temperatuur | 490[1] °C | ||||
| Dampdruk | 700[1] Pa | ||||
| Oplosbaarheid in water | 0,24[1] g/l | ||||
| Onoplosbaar in | water | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Voorkomen
Styreen komt in kleine hoeveelheden voor in bepaalde boomharsen, steenkoolteer en pyrolyseproducten van aardolie (ongeveer 7% van gekraakte benzine).
Synthese
Er bestaan voor styreen twee belangrijke productieprocessen. Bij het eerste wordt ethylbenzeen geoxideerd tot het hydroperoxide. Dit wordt samen met propeen en met behulp van hoge druk en een siliciumdioxide-katalysator omgezet tot propeenoxide en 1-fenylethanol. Dit alcohol wordt bij 200 °C gedehydreerd met behulp van aluminiumoxide, waardoor styreen gevormd wordt:
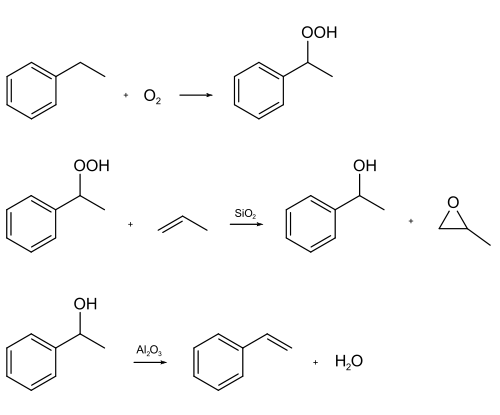 Synthese van styreen
Synthese van styreen
Het tweede - belangrijkere en meer toegepaste - proces betreft de katalytische dehydrogenering van ethylbenzeen met kaliumhydroxide of ijzer(III)oxide als katalysator bij 600-650 °C. De efficiëntie van het proces wordt verhoogd door toevoeging van een kleine hoeveelheid waterdamp.
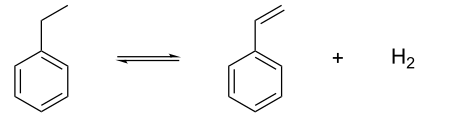 Synthese van styreen
Synthese van styreen
Een alternatieve synthese is de reactie van tolueen met synthesegas (een mengsel van koolstofmonoxide en waterstofgas):
Als katalysator wordt een basische of neutrale zeoliet gebruikt, in combinatie met één of meer promotoren. Deze promotoren zijn metalen zoals ruthenium, nikkel, kobalt of zirkonium.[2]
Toepassingen
Styreen wordt verwerkt tot een groot aantal verschillende kunststoffen. De belangrijkste hiervan is polystyreen. In 1997 werd 60% van het totaal geproduceerd styreen tot 660.000 ton polystyreen verwerkt. Polystyreen is daarmee een van de belangrijkste kunststoffen. Bovendien wordt het gebruikt bij de productie van copolymeren van acrylonitril-butadieen-styreen (ABS), acrylonitril-styreen (ASA), styreen-maleïnezuuranhydride (SMA) ,styreen-acrylnitril (SAN), styreen-butadieen en acrylonitril-styreen-acrylzure ester. Het wordt in kleine hoeveelheden aan parfums toegevoegd. Ook wordt het gebruikt als oplosmiddel bij de productie van polyesterharsen. Daarnaast is styreen een belangrijk tussenproduct bij de productie van fijnchemicaliën.
Externe links
| Zie de categorie Styrene van Wikimedia Commons voor mediabestanden over dit onderwerp. |
Bronnen, noten en/of referenties
|


