Lithiumboorhydride
Lithiumboorhydride (LiBH4) is een anorganische verbinding van lithium, boor en waterstof. De stof komt voor als een wit kristallijn poeder. Dit zout is een krachtige reductor. Het is goed oplosbaar in di-ethylether, maar reageert hevig met water:
Lithiumboorhydride
| |||||
| Structuurformule en molecuulmodel | |||||
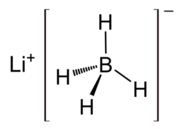 | |||||
Structuurformule van lithiumboorhydride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | LiBH4 | ||||
| IUPAC-naam | lithiumtetrahydroboraat(I-) | ||||
| Molmassa | 21,78376 g/mol | ||||
| SMILES | [Li+].[BH4-] | ||||
| InChI | 1S/BH4.Li/h1H4;/q-1;+1 | ||||
| CAS-nummer | 16949-15-8 | ||||
| PubChem | 4148881 | ||||
| Beschrijving | Wit kristallijn poeder | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H260 - H301 - H311 - H314 - H331 | ||||
| EUH-zinnen | EUH014 | ||||
| P-zinnen | P223 - P231+P232 - P261 - P280 - P370+P378 - P422 | ||||
| LD50 (muizen) | (oraal) 87,8 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 0,666 g/cm³ | ||||
| Smeltpunt | 275 °C | ||||
| Kookpunt | (ontleedt) 380 °C | ||||
| Zelfontbrandings- temperatuur | > 180 °C | ||||
| Goed oplosbaar in | di-ethylether | ||||
| C | 3,792 J/mol·K | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
Lithiumboorhydride kan bereid worden uit een metathesereactie van natriumboorhydride en lithiumbromide:[1]
Deze reactie wordt uitgevoerd onder inerte stikstofatmosfeer met di-ethylether als oplosmiddel.[2]
De rechtstreekse bereiding uit de elementen (lithium, boor en waterstofgas) is in principe mogelijk, maar vergt extreme reactieomstandigheden (temperatuur van 650°C en een druk van 150 atm). Een beter alternatief is de reactie tussen boraan en lithiumhydride:
Toepassingen
Lithiumboorhydride wordt hoofdzakelijk gebruikt als reductor voor aldehyden, ketonen, esters, lactonen en epoxiden. Het is een sterker reductans dan natriumboorhydride en is zelfs in staat om amiden te reduceren tot de overeenkomstige amines.
Externe links
Bronnen, noten en/of referenties
|


