Hexafluorethaan
Hexafluorethaan of perfluorethaan is het volledig gefluoreerde derivaat van de verzadigde koolwaterstof ethaan: alle zes waterstofatomen van ethaan zijn vervangen door fluoratomen. Het is een niet-brandbaar gas, dat vrijwel onoplosbaar is in water.
Hexafluorethaan
| ||||
| Structuurformule en molecuulmodel | ||||
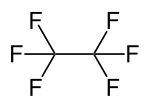 | ||||
Structuurformule van hexafluorethaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C2F6 | |||
| IUPAC-naam | hexafluorethaan | |||
| Andere namen | perfluorethaan, R116, freon 116, CFC-116 | |||
| Molmassa | 138,011819 g/mol | |||
| SMILES | C(C(F)(F)F)(F)(F)F | |||
| InChI | 1S/C2F6/c3-1(4,5)2(6,7)8 | |||
| CAS-nummer | 76-16-4 | |||
| EG-nummer | 200-939-8 | |||
| PubChem | 6431 | |||
| Beschrijving | Kleurloos en reukloos gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P410+P403 | |||
| VN-nummer | 2193 | |||
| ADR-klasse | Gevarenklasse 2.2 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Smeltpunt | −100,6 °C | |||
| Kookpunt | −78,2 °C | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Hexafluorethaan kan onder meer gevormd worden door de reactie van, al dan niet gechloreerd en/of gefluoreerd etheen met waterstoffluoride, of van ethaan met fluorgas.
Toepassingen
Hexafluorethaan wordt ingezet in de productie van halfgeleidercomponenten als etsgas of reinigingsgas. Het wordt ook gebruikt als koelmiddel.
Toxicologie en veiligheid
Hexafluorethaan is een gas dat ca. 4,8 keer zwaarder is dan lucht. De temperatuur en druk bij het kritisch punt zijn respectievelijk 19,7 °C en 29,8 bar.
Het gas tast de ozonlaag niet aan, en het is niet onderworpen aan het Montréal-protocol. Hexafluorethaan heeft echter een hoog aardopwarmingsvermogen, 12.200 keer zoveel als koolstofdioxide voor een periode van 100 jaar.[1]
| Bronnen, noten en/of referenties |
