Fenolftaleïne
Fenolftaleïne is een organische verbinding, meer bepaald een trifenylmethaankleurstof, met als brutoformule C20H14O4. De stof komt voor als witte tot lichtpaarse kristallen, die slecht oplosbaar zijn in water.
Fenolftaleïne
| ||||
| Structuurformule en molecuulmodel | ||||
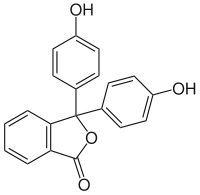 | ||||
Structuurformule van fenolftaleïne | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C20H14O4 | |||
| IUPAC-naam | 3,3-bis(4-hydroxyfenyl)-2-benzofuraan-1-on | |||
| Andere namen | agoral, 3,3-bis(4-hydroxyfenyl)-1-(3H)-isobenzofuranon, 3,3-bis(p-hydroxyfenyl)fthalide, chocolax, colax, correctol, darmol, dialose, doxidan, euchessina, femilax, koprol, laxin laxogen, prulet, purga, urgen, purgophen, trilax | |||
| Molmassa | 318,31 g/mol | |||
| SMILES | Zie voetnoot[1] | |||
| InChI | Zie voetnoot[2] | |||
| CAS-nummer | 77-09-8 | |||
| EG-nummer | 201-004-7 | |||
| PubChem | 4764 | |||
| Vergelijkbaar met | thymolftaleïne | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H341 - H350 - H361 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P201 - P281 - P308+P313 | |||
| MAC-waarde | 20 mg/m³ | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast[3] | |||
| Kleur | wit[3] | |||
| Dichtheid | 1,299[3] g/cm³ | |||
| Smeltpunt | 258-262[3] °C | |||
| Oplosbaarheid in water | 0,092[3] g/l | |||
| Goed oplosbaar in | ethanol | |||
| Slecht oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKa = 9,2 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
| Fenolftaleïne (pH-indicator) | ||
| onder pH 8,2 | boven pH 10 | |
| 8,2 | 10 | |
Synthese
Fenolftaleïne kan bereid worden uit een stoichiometrisch mengsel van gesmolten ftaalzuuranhydride en fenol onder de katalyse met geconcentreerd zwavelzuur.
Eigenschappen en toepassingen
Fenolftaleïne wordt hoofdzakelijk gebruikt als zuur-base-indicator, om bij een zuur-basetitraties het equivalentiepunt te bepalen. Het omslagpunt van de indicator wordt als equivalentiepunt beschouwd. Als indicator wordt fenolftaleïne vooral gebruikt bij titraties van een zuur (in de erlenmeyer) met een base (in de buret).
Omdat bij het omslagpunt van fenolftaleïne de oplossing al basisch is lost koolstofdioxide uit de lucht makkelijk op. De reactie heeft tot gevolg dat de oplossing minder basisch wordt omdat naast het carbonaat-anion ook water wordt gevormd. De oplossing wordt weer kleurloos. Er wordt daarom getitreerd tot de eerste violette kleur die in de oplossing stabiel blijft gedurende minstens 30 seconden.
Andere toepassingen zijn indicator voor bloed in de Kastle-Meyer-test en de verdwijnende haarkleurstof van Hollywood Hair Barbie.
Kleur van fenolftaleïne
Zoals veel indicatoren heeft een oplossing van deze stof bij lagere pH-waarden een andere kleur dan bij hogere: fenolftaleïne is bij een pH van 8,2 of lager kleurloos en bij een pH van 10,0 of hoger paarsrood. Echter, in een sterk basisch milieu (pH > 13,0) ontkleurt fenolftaleïne na korte tijd. De indicatoroplossing wordt bereid door 1 gram op te lossen in circa 50 milliliter ethanol, waarna het volume met gedemineraliseerd water op 100 milliliter gebracht wordt.
| Product | H3In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Structuurformule |  | 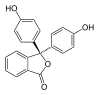 |  | 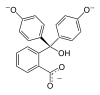 |
| Molecuulmodel | 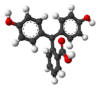 | 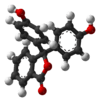 | 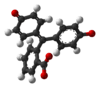 | 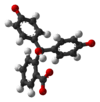 |
| pH | < 0 | 0 − 8,2 | 8,2 − 13,0 | > 13,0 |
| Omstandigheden | sterk zuur | zuur tot licht basisch | basisch | sterk basisch |
| Kleur | oranje | kleurloos | magenta | kleurloos |
| Afbeelding |  |  |
Zie ook
Externe links
Bronnen, noten en/of referenties
|
