Faseovergang
Een faseovergang, fasetransitie of fasetransformatie is in de thermodynamica de overgang van de ene fase van een stof naar de andere fase. Het stollen van water tot ijs (doorgaans bevriezen genoemd) en het verdampen van water tot waterdamp zijn voorbeelden van faseovergangen.
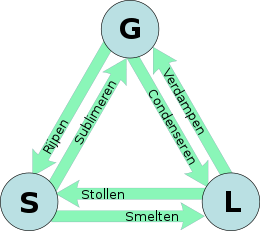
Verschillende faseovergangen zijn:
- smelten: van vast naar vloeibaar
- stollen (bevriezen): van vloeibaar naar vast
- verdampen: van vloeibaar naar gasvormig
- condenseren: van gasvormig naar vloeibaar
- sublimeren/vervluchtigen: van vast naar gasvormig
- rijpen/vervasten: van gasvormig naar vast
In de materiaalkunde wordt 'bij uitbreiding' ook gesproken over faseovergang binnen een vaste stof. In dit geval herschikken de atomen zich en verandert de kristalstructuur. Dit heeft een groot effect op enkele of vele verschillende materiaaleigenschappen. Wanneer faseovergangen plaatsvinden (zowel materiaalkundig gezien als normaal gesproken) hangt onder andere af van de soort stof, druk en temperatuur. Faseovergangen worden zichtbaar gemaakt in een fasediagram, welke verschillende variabelen tegen elkaar uitzet. Veelgebruikte diagrammen zijn de druk tegen temperatuur, voor bijvoorbeeld water of de temperatuur tegen de samenstelling van een materiaal.
Bij verdere uitbreiding beschouwt men iedere 'kwalitatieve' en scherp gedefinieerde verandering in een systeem als faseovergang. Bij zo'n faseovergang hoort dan een discontinuïteit in een thermodynamische grootheid of een afgeleide daarvan. Een voorbeeld van zo'n faseovergang is de overgang van ferromagnetisme naar paramagnetisme bij de Curietemperatuur. Bij faseovergangen hoort ook een ordeparameter, een grootheid die nul is aan de ene kant van de overgang en ongelijk aan nul aan de andere kant van de overgang (bijvoorbeeld de mate van spontane magnetisatie bij de zojuist genoemde overgang).
Faseovergangen worden geclassificeerd naar de orde van de faseovergang. Dit is de mate van discontinuïteit in de thermodynamische vrije energie die optreedt bij de faseovergang. Bij eerste-orde-faseovergangen is de vrije energie zelf discontinu, en is er sprake van latente warmte (alsmede een sprong in de ordeparameter en meestal hysterese). Bij een tweede-orde-faseovergang is de vrije energie continu.
Voor de meeste faseovergangen is (thermische) energie (in de vorm van warmte) nodig of komt er bij vrij. Van deze eigenschap wordt veel gebruikgemaakt, bijvoorbeeld bij koelen door het verdampen van water of een andere vloeistof. Zij kan dus ook worden gebruikt om faseovergangen van een onbekend materiaal te bepalen. Differentiële Thermische Analyse (DTA) en Differentiële Scanning Calorimetrie (DSC) zijn twee technieken die hierop gebaseerd zijn.
Daarnaast wordt er nu onderzoek gedaan naar het gebruik van zouten en paraffines als energie-opslag materiaal, ook wel faseovergangsmaterialen (PCM). Deze maken tijdens de faseovergang gebruik van de latente warmte voor opslag van warmte en afgifte van warmte.
Naar Van Vast Vloeibaar Gasvormig Vast --- Smelten Sublimatie Vloeibaar Stollen --- Verdamping Gasvormig Rijpen Condensatie ---