Waterdamp
Waterdamp is water in de gasfase. In de scheikunde wordt waterdamp aangeduid met H2O(g). Waterdamp is niet zichtbaar met het menselijk oog als er zich geen condensatie in voordoet. Boven een kop warme vloeistof wordt het condenserende water uit de damp wel zichtbaar omdat de omgevingstemperatuur onder het dauwpunt ligt (zie nevenstaande figuur).

Waterdamp in lucht met een temperatuur onder het kookpunt van water, kan worden beschouwd als een mengsel van gas en condens.
De hoeveelheid waterdamp per volume-eenheid lucht wordt de luchtvochtigheid genoemd. Daalt bij een bepaalde luchtvochtigheid de temperatuur van de lucht tot onder het dauwpunt, dan condenseert een gedeelte van het gasvormige water tot minuscule waterdruppeltjes: er ontstaat mist of bewolking.
Bij gelijke temperatuur is waterdamp lichter dan lucht.
Johannes Diderik van der Waals ontdekte dat de kritische temperatuur van waterdamp 390° C bedraagt; boven die temperatuur kan het 'watergas' zelfs door compressie niet meer vloeibaar gemaakt worden. Meer precies is de kritische temperatuur van water 647,096 K, dit is ~ 374°C, bij een kritische druk van 22064 kPa (217.7 atm).[1] De bijbehorende soortelijke massa bij het kritische punt is 322 kg/m3.
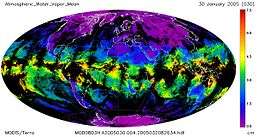
In de atmosfeer bevindt zich veel waterdamp. Waterdamp is een belangrijk broeikasgas en is essentieel in de waterkringloop. Aan de polen is de lucht droger dan rond de evenaar.
Zie ook
Bronnen, noten en/of referenties
|
| Zie de categorie Water vapor van Wikimedia Commons voor mediabestanden over dit onderwerp. |