Eiwitaggregatie
Eiwitaggregatie is het biologisch fenomeen waarbij verkeerd gevouwen eiwitten accumuleren en samenklonteren binnen of buiten de cel.[1][2] Het ontstaan van eiwitaggregaten hangt samen met verschillende aandoeningen, waaronder amyloïdoses, ALS, de ziekte van Alzheimer, ziekte van Parkinson en prionziekten.[3][4]
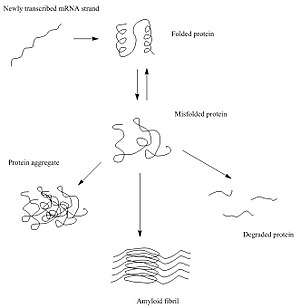
Nadat eiwitten gesynthetiseerd zijn vouwen ze zich in een specifieke driedimensionale structuur die het meest thermodynamisch gunstig is: hun natieve conformatie.[5] Dit vouwingsproces wordt aangedreven door verschillende (non)-covalente interacties: de aminozuren in het polypeptide trekken elkaar aan of stoten elkaar af. Ook de cellulaire omgeving heeft invloed: zo hebben zullen hydrofiele aminozuren meer aan de buitenkant van de conformatie voorkomen, en hydrofobe aminozuren meer aan de binnenkant. Alle interacties zorgen ervoor dat het eiwit een specifieke secundaire en een tertiaire structuur gaat aannemen.
Wanneer er veranderingen optreden in de aminozuursequentie, bijvoorbeeld door een genetische mutatie, kan het voorkomen dat het eiwit verkeerd vouwt. Wanneer de cel het eiwit niet helpt de juiste vouwing te herstellen of wanneer het ongevouwen eiwit niet wordt afgebroken, kan het verkeerd gevouwen eiwit gaan aggregeren; de hydrofobe delen van het eiwit (die normaal niet aan de buitenkant van het eiwit voorkomen) gaan interacties aan met de hydrofobe delen van andere eiwitten.[6][7]
Bronnen
|