Difosgeen
Difosgeen is een chloorhoudende, giftige verbinding met als brutoformule C2Cl4O2. Het is een heldere, kleurloze vloeistof met de geur van fosgeen, die lijkt op de geur van vers hooi.
Difosgeen
| ||||
| Structuurformule en molecuulmodel | ||||
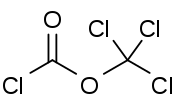 | ||||
Structuurformule van difosgeen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C2Cl4O2 | |||
| IUPAC-naam | trichloormethylchloorformiaat | |||
| Molmassa | 197,8322 g/mol | |||
| SMILES | C(=O)(OC(Cl)(Cl)Cl)Cl | |||
| InChI | 1S/C2Cl4O2/c3-1(7)8-2(4,5)6 | |||
| CAS-nummer | 503-38-8 | |||
| EG-nummer | 207-965-9 | |||
| PubChem | 10426 | |||
| Beschrijving | Heldere kleurloze vloeistof | |||
| Vergelijkbaar met | fosgeen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H300 - H314 - H330 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P260 - P264 - P280 - P284 - P301+P310 - P305+P351+P338 | |||
| VN-nummer | 2927 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,64 g/cm³ | |||
| Smeltpunt | −57 °C | |||
| Kookpunt | 128 °C | |||
| Dampdruk | (bij 20°C) 1370 Pa | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Het Duitse leger gebruikte difosgeen in de Eerste Wereldoorlog als verstikkend gas.
Synthese
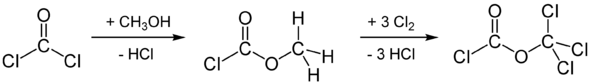
Difosgeen kan bereid worden door de chlorering van methylchloorformiaat, dat op zijn beurt bereid wordt uit fosgeen en methanol:
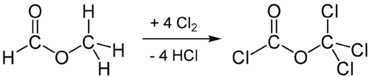
Dit is een radicalaire halogenering. Een andere mogelijkheid is de chlorering van methylformiaat:
Toepassingen
Difosgeen wordt gebruikt als minder gevaarlijk alternatief voor fosgeen. Als vloeistof is het eenvoudiger te vervoeren en op te slaan dan het gasvormige en uiterst giftige fosgeen. Het vindt toepassing bij de bereiding van onder andere (poly)carbonaten, isocyanaten en di-isocyanaten, en isocyaniden. Difosgeen wordt onmiddellijk vóór of, indien mogelijk, tijdens de reactie omgezet in fosgeen.
Toxicologie en veiligheid
Difosgeen is zeer giftig bij inslikken, huidcontact of inademing van de damp of aerosol. De stof kan brandwonden veroorzaken. Ze is ook traanverwekkend.
Met water reageert difosgeen hevig tot explosief: er ontstaan giftige en gevaarlijke ontbindingsproducten waaronder waterstofchloride, fosgeen en waterstofgas. Bij verwarmen rond 300 °C valt het uiteen (thermolyse) in twee moleculen fosgeen, of bij lagere temperatuur als een katalysator zoals actieve kool gebruikt wordt.
Externe link
- (en) Gegevens van Difosgeen in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)