Dichloorfenylfosfaan
Dichloorfenylfosfaan of dichloorfenylfosfine is een organische fosforverbinding met als brutoformule C6H5PCl2. Deze kleurloze, viskeuze vloeistof wordt veel gebruikt in de synthese van op fosfor gebaseerde liganden. Dichloorfenylfosfine is commercieel verkrijgbaar. De stof is erg toxisch en corrosief.
Dichloorfenylfosfaan
| |||||
| Structuurformule en molecuulmodel | |||||
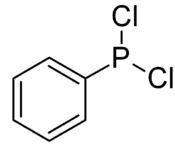 | |||||
Structuurformule van dichloorfenylfosfaan | |||||
 | |||||
Molecuulmodel van dichloorfenylfosfaan | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C6H5Cl2P | ||||
| IUPAC-naam | dichloorfenylfosfaan | ||||
| Andere namen | dichloorfenylfosfine, fenylfosfordichloride | ||||
| Molmassa | 178,983662 g/mol | ||||
| SMILES | ClP(Cl)c1ccccc1 | ||||
| InChI | 1/C6H5Cl2P/c7-9(8)6-4-2-1-3-5-6/h1-5H | ||||
| CAS-nummer | 644-97-3 | ||||
| PubChem | 12573 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H250 - H301 - H314 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P222 - P231 - P280 - P301+P310 - P305+P351+P338 - P422 | ||||
| VN-nummer | 2845 | ||||
| Fysische eigenschappen | |||||
| Smeltpunt | −51[1] °C | ||||
| Kookpunt | 222[1] °C | ||||
| Vlampunt | 113 °C | ||||
| Brekingsindex | 1,597[1] (589 nm, 20 °C) | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
De synthese verloopt via een elektrofiele aromatische substitutie uit benzeen en fosfortrichloride. Aluminiumchloride wordt daarbij als katalysator gebruikt.[2]
Toepassingen en reacties
Dichloorfenylfosfaan disproportioneert tot chloordifenylfosfaan in de gasfase bij hoge temperatuur:[3][4]
Met Grignard-reagentia, zoals bijvoorbeeld methylmagnesiumjodide, worden de chlooratomen vervangen door de organische rest in de Grignard-verbinding. Een voorbeeldreactie is de synthese van dimethylfenylfosfaan:
Dichloorfenylfosfaan reageert met dienen in de McCormack-reactie, met vorming van fosfolenen:[5][6]
 Reactieverloop van de McCormack-reactie
Reactieverloop van de McCormack-reactie
Bronnen, noten en/of referenties
|


