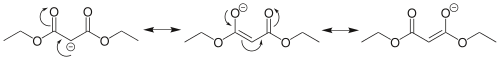Di-ethylmalonaat
Di-ethylmalonaat, ook bekend onder de afkorting DEM, is de diethylester van malonzuur. De stof komt van nature voor in druiven en aardbeien. De zuivere stof heeft een appelgeur en wordt toegepast in de parfumindustrie. Daarnaast vindt zij via de chemische en farmaceutische industrie toepassingen in de synthese van onder andere barbituraten, kunstmatige geurstoffen, vitamine B1 en vitamine B6.
Di-ethylmalonaat
| ||||
| Structuurformule en molecuulmodel | ||||
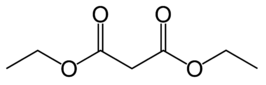 | ||||
Structuurformule van di-ethylmalonaat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C7H12O4 | |||
| IUPAC-naam | di-ethylpropaandioaat | |||
| Andere namen | DEM | |||
| Molmassa | 160,17 g/mol | |||
| SMILES | O=C(OCC)CC(=O)OCC | |||
| CAS-nummer | 105-53-3 | |||
| EG-nummer | 203-305-9 | |||
| PubChem | 7761 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H319 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P305+P351+P338 | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,05 g/cm³ | |||
| Smeltpunt | - 50 °C | |||
| Kookpunt | 199 °C | |||
| Vlampunt | 200[1] °C | |||
| Onoplosbaar in | water | |||
| Evenwichtsconstante(n) | pKz = 14 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Structuur en eigenschappen
De centrale methyleengroep van di-ethylmalonaat wordt geflankeerd door twee estergroepen, waardoor de protonen ervan zeer zuur zijn: de pKa bedraagt ongeveer 14. In malonzuur zelf wordt deze - relatief - grote zuursterkte gemaskeerd door de carboxygroepen. Van het anion van di-ethylmalonaat kunnen een aantal resonantiestructuren opgetekend worden:
Reacties
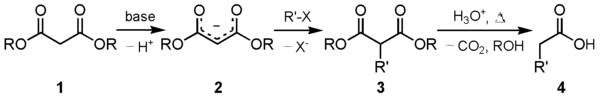
Malonzuurestersynthese
Een van de belangrijkste toepassingen van di-ethylmalonaat is de malonzuurestersynthese. Het carbanion 2 dat na reactie van DEM (1) met een sterke base ontstaat reageert met een geschikt elektrofiel. De op deze manier ontstane 1,3-dicarbonylverbinding (3) reageert makkelijk, onder verlies van koolstofdioxide, tot het gesubstitueerde azijnzuur (4):
Bij voorkeur wordt gebruik gemaakt van natriumethoxide in ethanol. Bij gebruik van natriumhydroxide, met water als oplosmiddel, wordt een deel van het product omgezet in het verzepingsproduct, het niet-gedecarboxyleerde dinatriumzout. Bij gebruik van een ander alcoholaat treedt omestering op, waardoor een mengsel van producten ontstaat. Met natriumethoxide levert de omestering het uitgangsmateriaal weer op.
Andere reacties
Zoals veel andere esters ondergaat di-ethylmalonaat een claisen-condensatie. Een voordeel van di-ethylmalonaat is dat - onbedoelde - zelfcondensatie met deze component niet kan optreden.
Bromeren op de α-positie is, net als bij andere esters mogelijk.[2] Met een overmaat natriumnitriet wordt in azijnzuur diethyloximinomalonaat gevormd, dat na katalytisch hydrogeneren over Pd/C in ethanol diethylaminomalonaat (DEAM) oplevert. DEAM kan worden omgezet in diethylacetamidomalonaat, uitgangsstof voor de synthese van aminozuren. Met 3-gesubstituteerde 2,4-diketonen kan DEAM in kokend azijnzuur omgezet worden in gesubstitueerde ethylpyrrool-2-carboxylaten die interessant zijn in de synthese van porfyrines.[3]
Bronnen, noten en/of referenties
|