Delta-binding
Een delta-binding of δ-binding is een relatief zeldzame vorm van covalente binding tussen twee atomen. De delta-binding wordt gevormd door de orbitaaloverlap van twee d-orbitalen tot een moleculair orbitaal, waarbij 4 loben ontstaan.[1] Dientengevolge zijn er 2 nodale vlakken aanwezig: zij staan loodrecht op elkaar en snijden elkaar in de bindingsas.
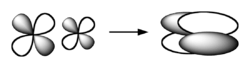
Deze vorm van binding tussen atomen wordt aangetroffen in de anorganische chemie, met name bij bindingen tussen twee overgangsmetalen en in organometaalverbindingen. De voorwaarde voor het vormen van een dergelijke covalente binding is dat de energie van de overlappende (bezette) d-orbitalen laag genoeg is. De binding tussen de twee molybdeen-atomen in Mo2 komt op deze manier tot stand. De binding is een viervoudige binding, bestaand uit 1 sigma-binding, 2 pi-bindingen en 1 delta-binding. Het moleculair orbitaal van de delta-binding kan als volgt worden voorgesteld:

Bronnen, noten en/of referenties
|
| Covalente binding | ||||||||
|---|---|---|---|---|---|---|---|---|
|