Chloraalhydraat
Chloraalhydraat (IUPAC-naam: 2,2,2-trichloroethaan-1,1-diol) is een organische verbinding met een kenmerkende geur en een aantal verschillende toepassingen. Binnen de geneeskunde en farmacie wordt chloraalhydraat meestal als chloralhydraat aangeduid.[1]
Chloraalhydraat
| ||||
| Structuurformule en molecuulmodel | ||||
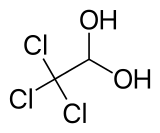 | ||||
Structuurformule van chloraalhydraat | ||||
Chloraalhydraatkristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C2H3Cl3O2 | |||
| IUPAC-naam | 2,2,2-trichloorethaan-1,1-diol | |||
| Andere namen | trichloroaceetaldehyde monohydraat, 1,1,1-trichloor-2,2-ethaandiol, Aquachloral, Novo-Chlorhydrate, Somnos, Noctec | |||
| Molmassa | 165,42 g/mol | |||
| SMILES | ClC(Cl)(Cl)C(O)O | |||
| CAS-nummer | 302-17-0 | |||
| EG-nummer | 206-117-5 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H315 - H319 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P301+P310 - P305+P351+P338 | |||
| Opslag | Op een donkere, koele en droge plaats bewaren. | |||
| LD50 (ratten) | (oraal) 479 mg/kg (huid) 3030 mg/kg (intraperitoneaal) 472 mg/kg (parenteraal en rectaal) 710 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,908 g/cm³ | |||
| Smeltpunt | 53 °C | |||
| Kookpunt | (ontleedt) 97,5 °C | |||
| Dampdruk | 1300 Pa | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Slaapmiddel
Chloraalhydraat veroorzaakt na toediening van enige honderden milligram een sterke en snel intredende maar niet erg langdurige slaperigheid. Als slaapmiddel wordt het in de geneeskunde niet of nauwelijks meer toegepast wegens gevaar voor verslaving en afhankelijkheid, en toxiciteit bij geringe overdosering (nauwe therapeutische breedte). In de veterinaire geneeskunde is het wel als anestheticum toegepast.
'Mickey Finn'
Een 'Mickey Finn' is een alcoholische consumptie met heimelijk toegevoegd chloraalhydraat. Het wordt door onscrupuleuze lieden (vooral in films maar ook wel in het echte leven) gebruikt om iemand suf of zelfs bewusteloos te maken door hem/haar dit te laten drinken (date rape drug).
Hoyers medium
Hoyers medium is een insluitmiddel voor microscopische preparaten, vooral geschikt om mijten in te bedden voor bestudering, omdat de brekingsindex geschikt is om ook doorzichtige delen van de mijt toch goed waar te nemen. Het medium bestaat voor een belangrijk deel uit chloraalhydraat. Preparaten die ermee worden gemaakt hebben echter de neiging na enige jaren tot decennia te bederven waardoor het voor permanente preparaten minder geschikt is.
Stabiliteit van het hydraat
In de organische structuurtheorie is chloraalhydraat een uitzondering die de regel bevestigt. Normaal zijn moleculen met twee hydroxygroepen aan één koolstofatoom, een geminaal diol (organisch hydraat), niet stabiel en wordt het overeenkomstige aldehyde of keton als meer stabiele vorm in waterige oplossingen aangetroffen. In chloraal heeft het koolstofatoom van de aldehydefunctie een hoge positieve partiële lading door de elektronegativiteit van het zuurstofatoom en de beweeglijkheid van de elektronen in de dubbele binding. Het andere koolstofatoom heeft ook een partiële positieve lading door de elektronegativiteit van de drie chlooratomen. De aanwezigheid van twee naburige partiële positieve ladingen wordt door de molecule opgelost door water op te nemen onder vorming van het diol.
Toxiciteit
Chloraalhydraat breekt in het lichaam hoofdzakelijk af tot 2,2,2-trichloorethanol, dat nadien verder gehydrolyseerd wordt tot onder andere azijnzuur. Het azijnzuur wordt veresterd met coënzym A. Vervolgens wordt van het acetaatgedeelte een proton (H+) van de methylgroep verwijderd zodat het acetaat overgdragen kan worden aan de eerste stap van de citroenzuurcyclus.
Tot en met de koppeling aan coënzym A is er voor chloraalhydraat niets bijzonders aan de hand. Geen van de drie chlooratomen kan echter als positief ion verwijderd worden. Overdragen aan de citroenzuurcyclus kan dus niet. Coënzym A is in cellen maar in een beperkte hoeveelheid beschikbaar. Het feit dat het niet mogelijk is het gechloreerde acetaat over te dragen aan de citroenzuurcyclus leidt tot verstopping van de celademhaling, en daarmee tot ernstige problemen voor de cel.
Bronnen, noten en/of referenties
|
