Buckminsterfullereen
Buckminsterfullereen is een allotroop van koolstof die opgebouwd is uit moleculen van 60 (of 70) koolstofatomen, die zijn gerangschikt in de vorm van een afgeknotte icosaëder, gelijkend op een voetbal. Telt de molecule 70 atomen dan neemt ze de vorm aan van een rugbybal. Deze molecule is na grafiet, diamant en amorfe koolstof de vierde vorm van koolstof en tevens de bekendste van de fullerenen. Buckminsterfullereen is een van de meest symmetrische moleculen en behoort tot puntgroep Ih.[1] Informeel spreekt men van buckybal of buckyball.
Buckminsterfullereen
| ||||
| Structuurformule en molecuulmodel | ||||
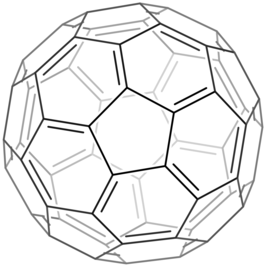 | ||||
Eén Lewisstructuur van buckminsterfullereen (van 12.400 mogelijkheden) | ||||
 | ||||
Oplossing van buckminsterfullereen in benzeen | ||||
 | ||||
Zuiver buckminsterfullereen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C60 | |||
| Molmassa | 720,66 g/mol | |||
| SMILES | C12=C3C4=C5C6= C1C7=C8C9 =C1C%10= C%11C(=C29)C3= C2C3=C4C4=C5C5=C9C6 =C7C6=C7C8= C1C1=C8C%10= C%10C%11=C2C2=C3C3 =C4C4=C5C5= C%11C%12 =C(C6=C95)C7= C1C1=C%12C5 =C%11C4=C3C3= C5C(=C81) C%10=C23 | |||
| InChI | 1/C60/c1-2-5-6-3(1) 8-12-10-4(1)9-11-7 (2)17-21-13(5)23-24-14(6) 22-18(8)28-20(12)30-26- 16(10)15(9)25-29- 19(11)27(17)37- 41-31(21)33(23)43- 44-34(24)32(22)42- 38(28)48-40(30) 46-36(26)35(25)45- 39(29)47(37)55- 49(41)51(43)57-52 (44)50(42)56(48)59- 54(46)53(45)58 (55)60(57)59 | |||
| CAS-nummer | 99685-96-8 | |||
| PubChem | 123591 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | bruin-zwart | |||
| Goed oplosbaar in | 1,2,4-trichloorbenzeen, koolstofdisulfide | |||
| Slecht oplosbaar in | organische oplosmiddelen | |||
| Onoplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Etymologie
Fullerenen in het algemeen en buckminsterfullereen in het bijzonder zijn genoemd naar de Amerikaanse architect Richard Buckminster Fuller, omdat de moleculaire vorm van deze stoffen doet denken aan de structuur van zijn geodetische koepels.
Ontdekking en betekenis
In een Science-artikel van 22 juli 2010 werd de Vlaamse astrofysicus Jan Cami erkend als de voornaamste ontdekker van de grote koolstofmoleculen ("buckyballs" of buckminsterfullereen) in het heelal. Het zijn de grootste moleculen die ooit in de ruimte werden aangetroffen. In laboratoria werd de molecule reeds ontdekt in de jaren 80. De ontdekking vond plaats toen de NASA met Spitzer infrarood ruimtetelescoop de gasresten van een planetaire nevel onderzocht op zo'n 6500 lichtjaar afstand van de Aarde. De ontdekking werd onder meer door Nobelprijswinnaar Harry Kroto als uiterst belangwekkend[2] aangeduid, omdat ze bijdraagt aan de kennis van het ontstaan van het leven op Aarde. De ontdekking toont aan dat door de inslag van meteorieten deze oerkoolstofmolecule op Aarde is terechtgekomen, waarna er koolstof ontstond en het eerste primitieve leven zich kon ontwikkelen.[3]
Synthese
Buckminsterfullereen kan gemaakt worden door een krachtige elektrische stroom door twee dicht bij elkaar geplaatste grafiet-elektrodes te laten lopen onder een inerte atmosfeer. Het grafiet verdampt daardoor en slaat gedeeltelijk neer als buckminsterfullereen.
Buckminsterfullereen kan ook vanuit eenvoudige basischemicaliën gemaakt worden met een klassieke organische synthese, maar de opbrengst is in dat geval zeer laag (minder dan 1%). Het kan gezuiverd worden door een kolomchromatografie met tolueen als eluens.
Chemische eigenschappen
Insluitverbindingen
Door hun bolvorm is het mogelijk om in een fullereenmolecuul een ander klein molecuul of een atoom in te sluiten, bijvoorbeeld een heliumatoom. De notatie voor de bijzondere insluitverbinding die dan ontstaat is He@C60.
Fulleriden
Een andere klasse afgeleid van buckminsterfullereen (en fullerenen in het algemeen) zijn de fulleriden. Dit zijn (vaste) verbindingen met bijvoorbeeld kalium (of andere alkalimetalen) waarin het fullereen als oxidator optreedt. Zowel K3C60 als K6C60 zijn bekend. De eerste stof is paramagnetisch, de tweede diamagnetisch zoals C60 zelf en dit hangt ten nauwste samen met de elektronenstructuur van C60.
Elektronische structuur
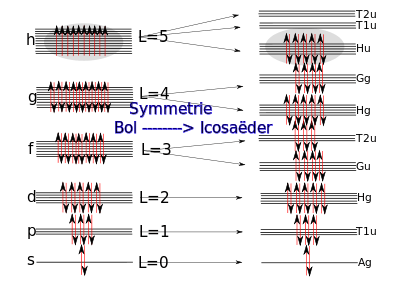
Het is mogelijk de elektronische structuur te benaderen vanuit een perspectief van de Lewistheorie en ieder atoom te verbinden met zijn drie buren via een enkele binding. Het vierde elektronenpaar (één elektron per koolstofatoom) dat nog rest is echter wat problematisch. Net als bij benzeen kunnen we beginnen een dubbele binding naar een van de buren te tekenen, maar dit kan op verschillende manieren. In plaats van twee alternatieve 'resonantie'structuren zijn er bij C60 zo'n 12.400 mogelijkheden.[4]
In analogie met benzeen is het beter het probleem aan te pakken met moleculaire orbitalen. Het volstaat in eerste instantie de discussie te beperken tot het overblijvende elektron dat in een p-orbitaal loodrecht op het oppervlak van een bol gedacht kan worden. Het vinden van de golfpatronen op het oppervlak van een bol is wiskundig gesproken nauw verwant aan het vinden van de orbitalen van een bolvormig waterstofatoom. Het is zelfs eenvoudiger. Het enige verschil is namelijk dat het probleem tweedimensionaal is en niet driedimensionaal. Dit heeft tot gevolg dat er in plaats van drie kwantumgetallen n, l en ml slechts twee zijn: L en mL. Bij het 3D-probleem resulteert de opeenvolging van 1s, 2s, 2p, 3s, 3p, 3d ... enz orbitalen. In het 2D-geval vervalt het n-getal en zijn er slechts s, p, d, f, g, h, i, enz. Net als bij de orbitalen van het 3D-atoom hebben zij een ontaardingsgraad van 1, 3, 5, 7, 9, 11 enz., en kunnen zij wegens de spin van het elektron 2, 6, 10, 14, 18 en 22 elektronen onderdak bieden. Doordat het ontbreken van het kwantumgetal n het aantal orbitalen vrij drastisch beperkt, raken - anders dan bij het periodiek systeem - ook g- en h-orbitalen gevuld.
Wanneer we de gevonden orbitalen vullen met de resterende 60 elektronen, blijkt dat 50 ervan in de s+p+d+f+g passen en er dan 10 elektronen overblijven die in de h-orbitalen gehuisvest moeten worden, waar plaats is voor 2*11=22 elektronen. Volgens de regel van Hund zou dat resulteren in een paramagnetische molecule die als vaste stof hoogstwaarschijnlijk een goede geleider zou zijn. Dit is echter niet geval, C60 heeft namelijk diamagnetische en halfgeleidende eigenschappen, met name bij lage temperaturen. De aanname dat de molecule bolvormig is, is echter niet geheel juist: in werkelijkheid is de symmetrie namelijk (een beetje) lager - de ware symmetrie is icosaëdrisch net als die van een voetbal. Het is mogelijk de orbitalen te bepalen in deze lagere symmetrie met gebruikmaking van de groepentheorie. Er blijkt dan dat de hoge ontaardingsgraad van de f-, g- en h-orbitalen gebroken wordt. De 7 f-orbitalen, die gelijke energie hebben voor een bol, splitsen op in een groep van 3 en een groep van 4 die twee verschillende energieën hebben. De 11 h-orbitalen splitsen op in een groep van 5 (Hu) en twee van 3 (T1u en T2u). Dit betekent dat alle elektronen nu gepaard in het vijfvoudig ontaarde niveau Hu geplaatst kunnen worden en dit verklaart de magnetische en elektrische eigenschappen.
Interessant is dat dit ook de elektrische en magnetische eigenschappen van de fulleriden K3C60 en K6C60 verklaart. De toevoeging van 3 resp. 6 elektronen vult het lege, drievoudig ontaarde niveau T1u gedeeltelijk resp. geheel op. Dit verklaart waarom K6C60 een diamagnetische halfgeleider is, terwijl K3C60 geleiding vertoont.
Bronnen, noten en/of referenties
|
| Allotropen van koolstof |
|---|
|
Natuurlijke allotropen: ballas · boort · carbonado · diamant · grafiet · lonsdaleïet Synthetische allotropen: buckminsterfullereen · fullereen · grafeen · hyperdiamant (ACNR) · koolstofnanoknop · koolstofnanobuis Verwante begrippen: adamant · aggregatietoestand · allotropie · kristalstructuur · vastestofchemie · vastestoffysica |
