Berylliumhydride
Berylliumhydride is een anorganische verbinding van beryllium en waterstof, met als brutoformule BeH2. Het is een witte amorfe vaste stof, die ontleedt in water.
Berylliumhydride
| |||||
| Structuurformule en molecuulmodel | |||||
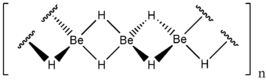 | |||||
Structuurformule van berylliumhydride | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | BeH2 | ||||
| IUPAC-naam | berylliumhydride | ||||
| Molmassa | 11,028062 g/mol | ||||
| SMILES | [H-].[H-].[Be+2] | ||||
| InChI | 1S/Be.2H/q+2;2*-1 | ||||
| CAS-nummer | 7787-52-2 | ||||
| PubChem | 139073 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H350i - H330 - H301 - H372 - H319 - H335 - H315 - H317 - H411 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | geen | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 0,65 g/cm³ | ||||
| Smeltpunt | (ontleedt) 250 °C | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
Berylliumhydride werd in 1951 voor het eerst gesynthetiseerd door de reactie tussen dimethylberyllium en lithiumaluminiumhydride:[1]
Een meer zuiver product kan bekomen worden door de pyrolyse van di-tert-butylberyllium bij 210°C:[2]
De meest zuivere vorm van berylliumhydride kan echter bereid worden uit reactie van trifenylfosfine en berylliumboorhydride:
Structuur en eigenschappen
In tegenstelling tot de andere hydriden van groep 2 is de binding tussen beryllium en waterstof niet ionair, maar covalent. De reden hiervoor is dat beryllium een zeer hoge ladingsdichtheid bezit en eerder de neiging zal hebben om een ander element te polariseren dan zelf elektronen af te staan. Aangezien beryllium elektrondeficiënt is, wordt een structuur aangenomen die analoog is aan die van boraan: twee H-atomen vormen steeds een brug tussen de berylliumatomen en vormen op deze manier een 3-center-2-elektronbinding. Berylliumchloride neemt een vergelijkbare structuur aan.
Berylliumhydride is een zeer toxische verbinding. In water ontleedt de verbinding tot berylliumhydroxide:
Toepassingen
Berylliumhydride wordt onder meer gebruikt als raketbrandstof en als moderatorstof in kernreactoren.
Bronnen, noten en/of referenties
|


