Azobenzeen
Azobenzeen is een organische verbinding met als brutoformule C12H10N2. De zuivere stof komt voor als een geel-rode kristallijne vaste stof, die zeer slecht oplosbaar is in water. Azobenzeen is de eenvoudigste aromatische azoverbinding, en kan beschouwd worden als de stamverbinding van de azokleurstoffen.
Azobenzeen
| |||||
| Structuurformule en molecuulmodel | |||||
 | |||||
Structuurformule van (E)-azobenzeen | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | C12H10N2 | ||||
| IUPAC-naam | difenyldiazeen | ||||
| Molmassa | 182,2212 g/mol | ||||
| SMILES | C1=CC=C(C=C1)N=NC2=CC=CC=C2 | ||||
| InChI | 1S/C12H10N2/c1-3-7-11(8-4-1)13-14-12-9-5-2-6-10-12/h1-10H | ||||
| CAS-nummer | 103-33-3 | ||||
| EG-nummer | 203-102-5 | ||||
| PubChem | 2272 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H332 - H341 - H350 - H373 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P201 - P273 - P281 - P308+P313 - P501 | ||||
| EG-Index-nummer | 611-001-00-6 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | oranje-rood | ||||
| Dichtheid | 1,09 g/cm³ | ||||
| Smeltpunt | 69 °C | ||||
| Kookpunt | 293 °C | ||||
| Vlampunt | 476 °C | ||||
| Oplosbaarheid in water | 0,0064 g/l | ||||
| Slecht oplosbaar in | water | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 0 D | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
Azobenzeen werd voor het eerst beschreven in 1856.[1] De oorspronkelijk gepubliceerde bereiding gebeurde door nitrobenzeen te reduceren met behulp van ijzervijlsel in aanwezigheid van azijnzuur. Tegenwoordig gebruikt men zinkpoeder als reductor in aanwezigheid van natriumhydroxide (A).[2] Andere mogelijke syntheseroutes betreffen de oxidatie van 1,2-difenylhydrazine met een natriumhypobromiet (B) en de condensatiereactie van nitrosobenzeen met aniline (C).
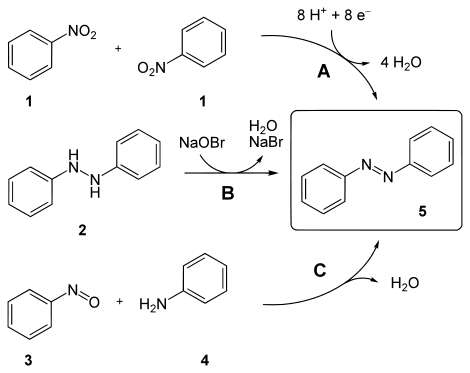 Synthesemethoden voor azobenzeen
Synthesemethoden voor azobenzeen
Isomerie
Door de aanwezigheid van de dubbele binding bestaan er twee cis-trans-isomeren van azobenzeen: (E)- en (Z)-azobenzeen. Het E- of trans-isomeer is de meest stabiele en komt dus het meest voor. Het Z-isomeer is door grote sterische hindering tussen de fenylgroepen minder stabiel. Beide isomeren kunnen omgezet worden in elkaar onder invloed van elektromagnetische straling van een bepaalde golflengte via een proces dat foto-isomerisatie wordt genoemd. Ultraviolet licht zet het E-isomeer om in het Z-isomeer, terwijl blauw licht (met een golflengte rond 470 nanometer) de omgekeerde reactie induceert.
 Isomeren van azobenzeen
Isomeren van azobenzeen
Externe links
- (en) MSDS van azobenzeen
- (en) Gegevens van Azobenzeen in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|


