18-kroon-6
18-kroon-6 is een organische verbinding met de formule [C2H4O]6. De IUPAC-naam is 1,4,7,10,13,16-hexaoxacyclooctadecaan. De stof vormt witte, hygroscopische kristallen met een tamelijk laag smeltpunt.[2] Zoals andere kroonethers is 18-kroon-6 een ligand voor een aantal metaalionen, met name voor kalium (K+). In methanol geldt voor complexatiereactie met kalium dat KD = 10−6 mol:
18-kroon-6
| ||||
| Structuurformule en molecuulmodel | ||||
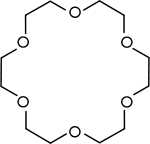 | ||||
Structuurformule van 18-kroon-6 | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C12H24O6 | |||
| IUPAC-naam | 1,4,7,10,13,16-hexaoxacyclooctadecaan | |||
| Andere namen | 18-C-6 | |||
| Molmassa | 264,315 g/mol | |||
| SMILES | C1COCCOCCOCCOCCOCCO1 | |||
| CAS-nummer | 17455-13-9 | |||
| PubChem | 24856618 | |||
| Vergelijkbaar met | dibenzo-18-crown-6, triglyme | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| EG-Index-nummer | 241-473-5 | |||
| LD50 (ratten) | 525 (oraal) mg/kg | |||
| LD50 (konijnen) | 3,888 (huid) mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | lichtgeel | |||
| Dichtheid | 1,237 g/cm³ | |||
| Smeltpunt | 37 – 40 °C | |||
| Kookpunt | (bij 0,2 mmHg) 116 °C | |||
| Vlampunt | 113[1] °C | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Structuur
Kristallografie van de zuivere verbinding, zonder gecomplexeerd kation, laat een tamelijk vlak molecuul zien, het molecuul vertoont echter niet de 6-voudige symmetrie die meestal getekend wordt: de onderste structuur hiernaast is een betere weergave van de werkelijke structuur van het molucuul dan de bovenste.[3] Bij de vorming van een complex gaat het molecuul over in een andere conformatie.
Synthese
De verbinding wordt gesynthetiseerd via een gemodificeerde Williamson-ethersynthese in aanwezigheid van een kation dat als mal functioneert.[4]
Oligomerisatie van etheenoxide is ook een mogelijkheid om de verbinding te bereiden:[2]
18-kroon-6 kan gezuiverd worden door middel van destillatie, waarbij ook de neiging tot onderkoelen opvalt. De stof kan eveneens gezuiverd worden via omkristalliseren uit hete acetonitril, waarbij een eerste instantie een onoplosbaar solvaat gevormd wordt.[4] Zeer droge (watervrije) 18-kroon-6 kan verkregen worden door een oplossing ervan in THF te behandelen met NaK. Er ontstaat dan [K(18-crown-6)]Na, een alkalidezout.
Reacties
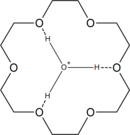 Het complex van H3O+ met 18-kroon-6 |
18-kroon-6 bindt een groot aantal kationen. De tamelijk vlakke structuur van de vrije ligand wordt om het metaalion gevouwen, waarbij een octaëdrische holte ontstaat.
18-kroon-6 vertoont een hoge affiniteit voor het ion H3O+. Dit ion past goed in de holte van de ether. In de reactie van 18-kroon-6 met sterke zuren ontstaat het ion [H3O⊂18-crown-6]+. In een oplossing van 18-kroon-6 in tolueen ontstaat met HCl-gas in aanwezigheid van een beetje vocht eerst een ionische vloeistoflaag met de samenstelling [H3O⊂18-crown-6]+[HCl2]−•3.8 C6H5Me. Uit deze ionische vloeistof ontstaat tijdens bewaren [H3O⊂18-crown-6]+[HCl2]−, wat geïsoleerd kan worden. Reactie van de ionische vloeistof met twee equivalenten water geeft het kristallijne (H5O2)[H3O⊂18-crown-6]Cl2.[2] |
Toepassingen
Hoewel kroonethers in het laboratorium toegepast worden als fase-transfer-katalysatoren.[5] geldt dit in minder mate voor 18-kroon-6 zelf. Wel is de toepassing beschreven van de combinatie kaliumpermanganaat / 18-kroon-6, in benzeen, in diverse organische oxidatiereacties.[2]
Verschillende substitutiereacties met nucleofielen in organische oplosmiddelen verlopen sneller als het tegenion kalium door 18-kroon-6 wordt gecomplexeerd. De complexvorming onderdrukt de paarvorming van kalium met het nucleofiel waardoor de anionen meer "naakte" nucleofielen worden. Zo is kaliumacetaat in aanwezigheid van 18-kroon-6 in organische oplosmiddelen een sterk nucleofiel:[2]
Het eerste elektride, een zout waarbij een kaal elektron het anion vormt, is in 1983 met 18-kroon-6 gesynthetiseerd en met behulp van Röntgendiffractie gekarakteriseerd. In deze zeer lucht- en vochtgevoelige vaste stof, [Cs(18-crown-6)2]+•e− met een sandwichstructuur is het elektron gevangen in een bijna bolvormige ruimte. De afstand tussen de twee elektronen, 868 pm is echter te groot om met behulp van dit materiaal een elektrische geleider te maken.[2]
Verwante verbindingen
Een verwante, maar in het algemeen betere complexvormer met de alkalimetalen is dibenzo-18-kroon-6.
Bronnen, noten en/of referenties
|

.png)