1-chloor-2-nitrobenzeen
1-chloor-2-nitrobenzeen is een organische verbinding met als brutoformule C6H4ClNO2. De stof bestaat uit gele tot groene kristallen met een kenmerkende geur en is onoplosbaar in water.
1-chloor-2-nitrobenzeen
| ||||
| Structuurformule en molecuulmodel | ||||
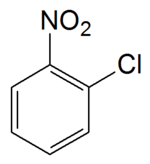 | ||||
Structuurformule van 2-chloor-1-nitrobenzeen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C6H4ClNO2 | |||
| IUPAC-naam | 1-chloor-2-nitrobenzeen | |||
| Andere namen | o-chloornitrobenzeen, o-nitrochloorbenzeen, 2-chloor-1-nitrobenzeen | |||
| Molmassa | 157,554 g/mol | |||
| CAS-nummer | 88-73-3 | |||
| EG-nummer | 201-854-9 | |||
| Beschrijving | Gele tot groene kristallen met kenmerkende geur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H311 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P301+P310 - P312 | |||
| Opslag | Gescheiden van brandbare en reducerende stoffen, voeding en voedingsmiddelen. | |||
| VN-nummer | 1578 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | geel-groen | |||
| Dichtheid | 1,4 g/cm³ | |||
| Smeltpunt | 33 °C | |||
| Kookpunt | 246 °C | |||
| Vlampunt | 124 °C | |||
| Zelfontbrandings- temperatuur | 487 °C | |||
| Dampdruk | 600 Pa | |||
| Onoplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
1-chloor-2-nitrobenzeen kan bereid worden door de aromatische nitrering van chloorbenzeen. De reactie levert een mengsel op van de drie isomeren:
- 1-chloor-2-nitrobenzeen (het ortho-isomeer)
- 1-chloor-3-nitrobenzeen (het meta-isomeer)
- 1-chloor-4-nitrobenzeen (het para-isomeer)
Het mengsel bestaat voor ca. 62% uit de para-isomeer, 36% ortho-isomeer en slechts 2% meta-isomeer. Er wordt ook een kleine hoeveelheid dinitrochloorbenzeen gevormd. De isomeren worden dan door destillatie en kristallisatie van elkaar gescheiden.[1][2]
Toepassingen
1-chloor-2-nitrobenzeen is een tussenproduct in de chemische industrie, onder meer voor 2-nitroaniline. Het wordt gebruikt bij de productie van verfstoffen, farmaceutische stoffen, fungiciden, antimicrobiële stoffen en in de parfumindustrie.
Toxicologie en veiligheid
De stof ontleedt bij verbranding met vorming van giftige en corrosieve dampen (onder andere stikstofoxiden, chloor, waterstofchloride en fosgeen). Het is een sterk oxidatiemiddel en reageert met brandbare en reducerende stoffen.
Externe links

- (en) Gegevens van 1-chloor-2-nitrobenzeen in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
| Bronnen, noten en/of referenties |
