Wolfraam(VI)chloride
Wolfraam(VI)chloride is een anorganische verbinding met als brutoformule WCl6. De stof komt voor als een donkervioletblauwe vluchtige vaste stof. Het is een belangrijke uitgangsstof bij de bereiding van andere wolfraamverbindingen.[2] Wolfraam(VI)chloride is een van de weinige neutrale hexachloriden; een andere is renium(VI)chloride (ReCl6). Molybdeen(VI)chloride (MoCl6) bestaat niet. Beter bekend dan wolfraam(VI)chloride is het nog vluchtigere wolfraam(VI)fluoride (WF6).
Wolfraam(VI)chloride
| ||||
| Structuurformule en molecuulmodel | ||||
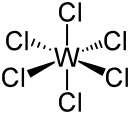 | ||||
Structuurformule van wolfraam(VI)chloride | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | Cl6W | |||
| IUPAC-naam | wolfraam(VI)chloride | |||
| Andere namen | wolfraamhexachloride | |||
| Molmassa | 396,558 g/mol | |||
| SMILES | Cl[W](Cl)(Cl)(Cl)(Cl)Cl | |||
| InChI | 1/6ClH.W/h6*1H;/q;;;;;;+6/p-6/f6Cl.W/h6*1h;/q6*-1;m/rCl6W/c1-7(2,3,4,5)6 | |||
| CAS-nummer | 13283-01-7 | |||
| EG-nummer | 236-293-9 | |||
| PubChem | 83301 | |||
| Vergelijkbaar met | Wolfraam(VI)fluoride | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| Hygroscopisch? | ja | |||
| Omgang | Niet inademen, contact en blootstelling vermijden. | |||
| VN-nummer | 3260 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vaste stof | |||
| Kleur | donkerblauw | |||
| Dichtheid | 3,52[1] g/cm³ | |||
| Smeltpunt | 275[1] °C | |||
| Kookpunt | 346[1] °C | |||
| Goed oplosbaar in | chloorkoolwaterstoffen | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | (α-vorm) trigonaal (β-vorm) hexagonaal | |||
| Dipoolmoment | 0 D | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Structuur en eigenschappen
Het centrale atoom in de octaëdrische molecule heeft een d0-configuratie en is derhalve net als afgeleide vormen met wolfraam(VI) diamagnetisch. De W-Cl-bindinglengten zijn gelijk: 224 tot 226 pm.[3]
Kristalstructuur
Wolfraam(VI)chloride kent twee kristalstructuren. De alfastructuur is stabiel onder 226°C en heeft een trigonale structuur. Boven deze temperatuur wordt de structuur hexagonaal; dit is de bètavorm. In beide structuren zijn discrete WCl6-octaëders te herkennen en de chlooratomen vormen vrijwel dezelfde dichtste stapeling. De wolfraamatomen bevinden zich echter in andere octaëdrische holten binnen deze dichtste stapeling.[3]
Reacties
Methylering met trimethylaluminium vormt hexamethylwolfraam. Met n-butyllithium ontstaat een reagens dat gebruikt kan worden voor de deoxygenatie van epoxiden.[4]
De chlorideliganden in wolfraam(VI)chloride kunnen vervangen worden door een groot aantal andere anionische liganden zoals Br−, NCS− en RO− (R = alkyl of aryl).
Toxicologie en veiligheid
Wolfraam(VI)chloride is een agressieve en corrosieve oxidator die onder invloed van vocht omgezet wordt in zoutzuur.
Externe links
- (en) MSDS van wolfraam(VI)chloride[dode link]
Bronnen, noten en/of referenties
|
