Complex regionaal pijnsyndroom
Het complex regionaal pijnsyndroom (CRPS), ook wel posttraumatische dystrofie (PD), of Sudeckse dystrofie genoemd naar de Duitse chirurg Paul Sudeck[1] (1866-1945), die als een van de eersten de aandoening uitvoerig beschreef, is een syndroom met continue diffuse pijn in een ledemaat, vaak een brandend gevoel, meestal na een letsel of schadelijke prikkel en inactiviteit, met variërende veranderingen in het gevoel, de spierwerking en de doorbloeding en vaak met atrofie gepaard gaand.
| Neem het voorbehoud bij medische informatie in acht. Raadpleeg bij gezondheidsklachten een arts. |
complex regionaal pijnsyndroom
| ||||
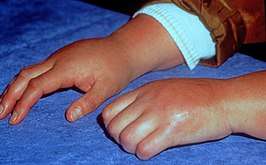 | ||||
CRPS aan de handen en polsen | ||||
| Coderingen | ||||
| ICD-10 | M89.0, G56.4 | |||
| ICD-9 | 337.21, 337.22, 354.4, 355.71 | |||
| DiseasesDB | 12635 16345 | |||
| eMedicine | pmr/123 | |||
| MeSH | D020918 | |||
| ||||
Het is een slecht begrepen aandoening die aan een ledemaat kan ontstaan, meestal aan voet of hand, na letsel, vaak een opvallend klein of relatief onbeduidend letsel, zoals een lichte verstuiking of zelfs een prik van een injectienaald of een doorn. Hierdoor wordt het vegetatieve systeem ontregeld en herijkt zich daarna verkeerd zodat de vegetatieve veranderingen waaronder pijn blijven aanhouden. De aandoening kan echter ook geheel spontaan ontstaan.
Het syndroom komt voor bij alle leeftijden, met een piek tussen 30 en 70 jaar. Vrouwen lopen een groter risico dan mannen (75% meer vrouwen dan mannen). CRPS treedt meestal op in de extremiteiten (zoals pols/hand/onderarm, schouder en enkel/voet).
Ontstaan en verschijnselen
De meest voorkomende oorzaak is een voorafgaand trauma (in > 50% van de gevallen), inclusief medische (be)handelingen (bijvoorbeeld een operatie, maar soms zelfs alleen een injectie). In dat geval wordt het vaak posttraumatische dystrofie genoemd. Andere mogelijke oorzaken zijn immobilisatie, stress, depressie, hoewel er geen hard bewijs is voor psychische oorzaak van CRPS.
De pathofysiologie van CRPS is onbekend, maar er wordt gedacht aan genetische vatbaarheid en immunologische afwijkingen. Op basis van de huidige inzichten wordt CRPS gedacht veroorzaakt te worden door lokale ontsteking met veranderingen in het centrale zenuwstelsel.
Aanvankelijk valt vooral op dat het getroffen ledemaat veel meer pijn doet, en dat deze pijn veel langer aanhoudt dan je zou verwachten aan de hand van het letsel. Naderhand ontstaan er meer symptomen die wijzen op een vegetatieve dysregulatie (doorbloeding, temperatuursregulatie), waarbij het ledemaat blauw, paars of juist wit kan worden, de spieren uiteindelijk (ook door het niet gebruiken van het ledemaat) gaan atrofiëren en soms het bot kalk verliest en broos wordt. Deze symptomen treden op in een groter gebied dan het aanvankelijk aangedane gebied (bv. bij een verstuikte enkel gaat het hele onderbeen meedoen). Is dat niet het geval, dan mag per definitie niet van posttraumatische dystrofie worden gesproken. Het ledemaat doet hevig pijn waardoor de patiënt het vaak vrijwel niet meer durft te gebruiken. Dit is misschien een factor bij het in stand houden van de ziekte, zie verderop.
Er is geen objectieve standaard of laboratoriumtest beschikbaar voor het stellen van een diagnose. Daarom worden klinische observaties, onderzoek en de klachten van de patiënt zelf gebruikt.[2]
Symptomen
De klinische presentatie van CRPS wordt gekenmerkt door de volgende symptomen:
- Continue hevige pijn
- kleurverandering (blauw -> paars)
- Gevoelsstoornissen
- Temperatuurverandering (warm -> zeer koud)
- Zwelling
- (Overmatig) zweten
- Motorische stoornissen, zoals spierzwakte, tremoren en spasmen
- Haar- en nagelgroei
Er worden twee typen CRPS onderscheiden:
- CRPS1 (voorheen: reflex sympathische dystrofie): geen aantoonbare zenuwschade (bijvoorbeeld geen uitval en niet afwijkend EMG)
- CRPS2 (voorheen: causalgie): aantoonbare zenuwschade (bijvoorbeeld uitval en afwijkend EMG)
Voorkomen
PD kan op elke leeftijd voorkomen. Volgens een studie[3] op basis van veel Nederlandse patiëntendossiers treft het 1 op de 4000 personen per jaar. Vrouwen krijgen het ruim 3 keer vaker dan mannen en vooral vrouwen in de leeftijdscategorie van 61-70 jaar. De bovenste ledematen krijgen het eerder dan de onderste en een breuk is in de meeste gevallen (44%) de oorzaak dat het zich voor gaat doen.
Verloop en behandeling
Omdat de pathofysiologie van CRPS onduidelijk is, bestaat er geen bewezen effectieve therapie[4]. Sommige Nederlandse artsen claimen dat zuurstofradicalen een rol spelen in de acute fase van CRPS en denken daarom dat stoffen die zuurstofradicalen wegvangen, zoals vitamine C, acetylcysteïne en dimethylsulfoxidecrème, effectief zijn tegen CRPS. De algemene behandeling bestaat uit activatie en mobilisatie, eventueel met behulp van een fysiotherapeut. De richtlijn schrijft voor om te oefenen op zodanige wijze dat binnen twee uur na het staken van de oefening de klachten minimaal gereduceerd zijn tot het niveau van aanvang. (Overmatig) bewegen kan de klachten in de acute fase echter verergeren, terwijl niet bewegen ook een nadelige invloed heeft op het beloop van het ziektebeeld.
Pijnstillers, zoals paracetamol, NSAIDs en morfine, zijn niet effectief bij CRPS, omdat geen sprake is van ontstekingspijn, maar van neuropathische pijn. Neuropathische pijn reageert beter op co-analgetica, dat wil zeggen: medicijnen die oorspronkelijk niet bedoeld zijn als pijnstiller, maar als gunstige 'bijwerking' kunnen hebben dat ze de pijn verminderen. Voorbeelden van co-analgetica die effectief zijn bij CRPS, zijn tricyclische antidepressiva en anti-epileptica. Een andere manier van pijnbestrijding bij CRPS is transcutane elektrostimulatie.
Vrij vaak gaat het in het begin nog spontaan over. Hoewel door behandelteams vaak wordt beweerd dat de kansen op herstel beter zijn als er vroeg met de behandeling wordt begonnen is nog nooit aangetoond dat het schijnbaar betere resultaat bij vroege behandeling niet het gevolg is van de natuurlijke neiging tot genezing van lichte gevallen. Uit gerandomiseerde klinische proeven blijkt dat het gebruik van 500 mg vitamine C per dag, de kans op het optreden van posttraumatische dystrofie vermindert na polsfracturen.[5]
Getracht werd en wordt tot nu toe de patiënt door middel van pijnstilling en vaatverwijders te genezen, vaak door intensieve behandeling door een pijnteam. Of dit effectief is als behandeling is echter nog maar zelden door gecontroleerd onafhankelijk wetenschappelijk onderzoek aangetoond. Uit onderzoek blijkt evenwel dat ketamine veelbelovend is voor pijnbestrijding.[6]
Er zijn factoren bekend (triggers) die de dystrofie kunnen uitlokken, onderhouden dan wel verergeren. Enkele voorbeelden zijn het carpaletunnelsyndroom, een neuroom, een triggerfinger of ulnabandirritatie. Hier dient gericht naar gezocht te worden. Het ligt voor de hand dat door tijdige diagnose en gerichte behandeling van deze - vaak pijnlijke - triggers de vooruitzichten aanzienlijk verbeteren. Een specifieke vorm van posttraumatische dystrofie is het schouder-hand-syndroom, waarbij het gehele bovenste ledemaat is aangedaan. Ook hier kunnen triggers een rol spelen, zoals afklemming van de vaatzenuwbundel naar de arm (het thoracic outlet compression syndrome) ten gevolge van verkleining van de piramidale ruimte in de borstholte waardoorheen bloedvaten en zenuwen van de borst naar de arm lopen. Deze piramidale ruimte is bij vrouwen aanzienlijk kleiner dan bij mannen. Deze armafklemming (tocs) kan volgens sommigen onder andere worden veroorzaakt door een verdraaide eerste borstwervel (vertebra (t1) facet lock). Door middel van een chirurgische ingreep kan een "gelockte" wervel worden teruggedraaid ("unlocken"). Dit kan ook bereikt worden door een grote kracht in de juiste richting op de wervel uit te oefenen (biomechanische tractie). Het moge duidelijk zijn dat het vaak niet eenvoudig is triggers voor posttraumatische dystrofie op te sporen. Overigens is lang niet iedereen die werkzaam is op dit gebied van het bestaan van dergelijke triggers overtuigd.
Bij sommige patiënten zijn in het verleden zelfs in geval van ernstige levensbedreigende infecties ledematen geamputeerd. Deze ingreep kan echter averechts werken, omdat dan een ander ledemaat de ziekte overneemt. Het komt ook wel voor dat iemand met een dystrofische voet een dystrofische arm krijgt door het infuus dat voor de behandeling van het been wordt gegeven.
'Macedonische methode'
In 2004 ontstond enige commotie omtrent PD, doordat in de media aandacht werd besteed aan een alternatieve genezeres - in de media werd zij steevast Mevrouw Shinka genoemd - in Macedonië. Zij claimt deze aandoening te kunnen genezen. Een Nederlandse delegatie van anesthesisten en fysiotherapeuten, met een aantal in Nederland vrijwel uitbehandelde patiënten bezocht haar, samen met een filmploeg om deze behandeling te kunnen zien en filmen.
De behandeling van mevrouw Shinka, die nu ook wel de Macedonische methode of soms ook weleens de shinkamethode genoemd wordt, is naar eigen zeggen niet gericht op pijnbestrijding maar op het juist functioneren van de ledematen. Zij negeert de pijn van haar patiënten. Deze schreeuwen het soms letterlijk uit van de pijn. Geheel tegen alle gebruikelijke behandeltechnieken in, stimuleert Shinka de aangetaste ledematen krachtig. Een aanzienlijk percentage van de behandelde patiënten keerde sterk verbeterd of geheel genezen huiswaarts. In Nederland is geprobeerd deze bevinding te reproduceren, waarbij er van de hypothese uitgegaan werd dat een van de voornaamste factoren die het probleem in stand houden de bewegings- en gebruiksangst van het lichaamsdeel van de patiënt is. Hier is geen wetenschappelijk bewijs voor, voor het tegendeel overigens ook niet.
De eerste resultaten van deze benadering lijken veelbelovend.[7][8]
Noten
Externe links |